题目内容
【题目】铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是
A.放电时,正极附近pH 减小
B.充电时,铅蓄电池的负极连接电源的正极
C.放电时,负极的电极反应式为:Pb-2e-=Pb2+
D.充电时,阴极的电极反应式为:PbSO4+2e-=Pb+![]()
【答案】D
【解析】
A.放电时,该装置是原电池,原电池的正极材料是PbO2,PbO2得电子,发生还原反应,其电极反应为PbO2+4H++SO42-+2e-=2H2O+PbSO4,消耗H+,pH增大,故A错误;
B.充电时,该装置是电解池,铅蓄电池的负极与外加电源的负极相连,为阴极,发生还原反应,即PbSO4+2e-═Pb+SO42-,故B错误;
C.放电时,该装置是原电池,原电池的负极材料是铅,铅失电子发生氧化反应,其电极反应为Pb+SO42--2e-=PbSO4,故C错误;
D.在充电时,该装置是电解池,阴极上硫酸铅得电子发生还原反应,即PbSO4+2e-═Pb+SO42-,故D正确;
答案为D。

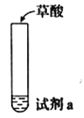
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O