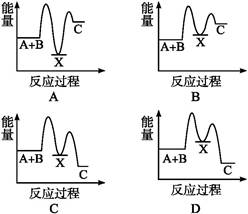
题目内容
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( )
| A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |
A
解析

练习册系列答案
相关题目
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1 |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.△H<0,△S>0的化学反应一定能自发进行 |
C.已知热化学方程式2SO2(g)+O2(g) 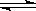 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |
下列图示与对应的叙述相符的是
| A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 |
| B.图2表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液的pH随加入盐酸体积的变化 |
| C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 |
| D.根据图4可判断某可逆反应的正反应是吸热反应 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )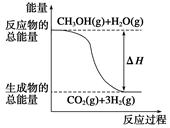
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+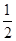 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+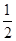 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
炎热的夏季里,能喝上一口冰镇饮料是非常惬意的事情。目前,一种人称“摇摇冰”的即冷即用饮料已经上市。所谓“摇摇冰”,是指吸食前将饮料隔离层中的制冷物质和水混合摇动能使罐中饮料冷却。若该制冷物质可以在下列物质中选择,它应该是( )。
| A.氯化钠 | B.固体硝酸铵 | C.固体氧化钠 | D.固体氢氧化钠 |
已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是 ( )
A.N2(g)+3H2(g)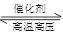 2NH3(g) ΔH=-93 kJ·mol-1 2NH3(g) ΔH=-93 kJ·mol-1 |
B.N2(g)+3H2(g)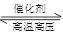 2NH3(g) ΔH=+1471 kJ·mol-1 2NH3(g) ΔH=+1471 kJ·mol-1 |
C.N2(g)+3H2(g)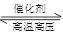 2NH3(g) ΔH=+93 kJ·mol-1 2NH3(g) ΔH=+93 kJ·mol-1 |
D.N2(g)+3H2(g)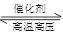 2NH3(g) ΔH=-1471 kJ·mol-1 2NH3(g) ΔH=-1471 kJ·mol-1 |
在下列反应中,生成物的能量总和高于反应物的能量总和的是
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) 放热反应 |
| B.2CO(g)+O2(g)=2CO2(g) 放热反应 |
| C.CaCO3(s)=CaO(s)+CO2 吸热反应 |
| D.H+(aq)+OH-(aq)=H2O(l) 放热反应 |