题目内容
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1 |
A
解析试题分析:A、根据中和热的概念判断,稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1,正确;B、根据燃烧热的概念判断,水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H =" +571.0" kJ·mol-1,错误;C、根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物时放出的热量判断,已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1,错误;D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式应为 H2(g)+1/2O2(g)=H2O(g) △ H=-285.8 kJ· mol-1,错误。
考点:考查燃烧热、中和热的概念及热化学方程式的正误判断。

 名校课堂系列答案
名校课堂系列答案下列各组物质的燃烧热相等的是( )
| A.碳和一氧化碳 |
| B.1 g碳和2 mol碳 |
| C.淀粉和纤维素 |
| D.3 mol乙炔(C2H2)和1 mol苯(C6H6) |
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/kJ/mol | 1 366 | 5 518 | 283 | 286 |
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
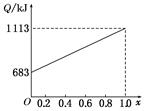
(1)甲、乙的相对分子质量为:Mr(甲)= ,Mr(乙)= 。
(2)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO mol。
实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是( )
| A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个 |
| B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个 |
| C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个 |
| D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个 |
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
| A.H2与F2反应的热化学方程式为: H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
下列图示与对应的叙述相符的是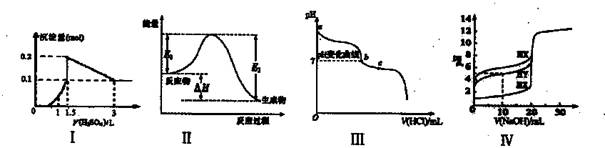
| A.图I表示向1L浓度均为0.1 mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液,产生沉淀量的变化 |
| B.图Ⅱ中逆反应的热效应△H=E1- E2 <0,所以逆反应为放热反应 |
| C.图Ⅲ表示向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,溶液pH的变化,c点溶液中:c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+) |
| D.用0.1 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图Ⅳ曲线可确定HX的酸性最强 |
已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列说法正确的是( )
| A.中和热一定是强酸跟强碱反应放出的热量 |
| B.1 mol酸与1 mol 碱完全反应放出的热量是中和热 |
| C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( )
| A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |