题目内容
下列图示与对应的叙述相符的是
| A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 |
| B.图2表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液的pH随加入盐酸体积的变化 |
| C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 |
| D.根据图4可判断某可逆反应的正反应是吸热反应 |
A
解析试题分析:A、向某硫酸和硫酸铝混合溶液中加入NaOH溶液,开始无沉淀,后产生沉淀,继续滴加沉淀消失,且产生沉淀与溶解沉淀所用氢氧化钠的体积比为3:1,正确;B、开始Ph=13,加入20mL盐酸时Ph=7继续滴加pH<7,但只能接近1,而不是接近0,错误;C、未加水时导电能力为0,错误;D、根据图4可判断某可逆反应的正反应是放热反应,因为随温度升高化学平衡向逆反应方向移动,错误,答案选A。
考点:考查化学中的图像分析

H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( )
| A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |
已知化学反应2C(s)+O2(g)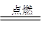 2CO(g)、2CO(g)+O2(g)
2CO(g)、2CO(g)+O2(g)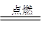 2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
| A.12 g C所具有的能量一定高于28 g CO所具有的能量 |
| B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
如图所示,把下列物质分别加入装有水的锥形瓶里,立即塞紧带有U形管的塞子,已知U形管内预先装有少量水(为方便观察,预先将水染成红色),结果U形管左边液面升高,则加入的物质可能是( )。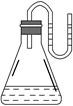
| A.NaOH固体 | B.浓硫酸 | C.NH4NO3晶体 | D.Na2O2固体 |
中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是( )
| A.1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液 |
| B.1mol/L的稀H2SO4溶液与1mol/L的稀Ba(OH)2溶液 |
| C.1 L 1mol/L的稀HCl溶液与2 L 1mol/L的稀NaOH溶液 |
| D.1 L 1mol/L的稀H2SO4溶液与1 L 1mol/L的稀Ba(OH)2溶液 |
已知25℃时:
①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH1=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1
③Ba2+(aq)+SO42—(aq)=BaSO4(s) ΔH3<0
下列说法正确的是( )
| A.HF的电离方程式及热效应:HF(aq)=H+(aq)+F-(aq) ΔH>0 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
| C.ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6 kJ·mol-1 |
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )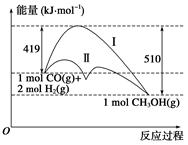
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |
下列说法不正确的是( )
| A.反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能储存起来 |
| C.吸热反应中由于反应物总能量小于生成物总能量,因而无利用价值 |
| D.物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |