题目内容
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.△H<0,△S>0的化学反应一定能自发进行 |
C.已知热化学方程式2SO2(g)+O2(g) 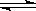 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |
B
解析试题分析:A.若熵值增大,△H>0,根据自发进行的判断依据是△G=△H-T△S<0,则该反应在低温不能自发进行,故A错误;B.△H<0,△S>0的化学反应△G=△H-T△S<0一定能自发进行.正确;C.可逆反应存在一定的限度,不可能全部反应,所以2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后放出小于Q kJ 的热量,故C错误;D.CH2COOH电离要吸收热量,所以1molNaOH分别和1molCH2COOH、1molHHO3反应,后者必前者放出的热量多,故D不正确;
考点:考查了反应热的计算以及反应热大小的比较

已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,下列叙述正确的是
| A.每生成2分子AB吸收bkJ热量 |
| B.该反应热△H=(b -a)kJ·mol-1 |
| C.反应物的总能量低于生成物的总能量 |
| D.断裂1molA—A和1molB—B键,放出akJ能量 |
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断
C(g)+D(g)过程中的能量变化如图所示,由此可判断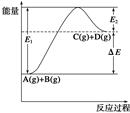
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=c kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是 ( )
| A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.反应物的总能量高于生成物的总能量 |
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g);ΔH=-Q1kJ/mol;CO(g)+1/2 O2(g)=CO2(g);ΔH=-Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是( )
| A.1/3Q1 kJ | B.1/3Q2 kJ | C.1/3(Q1+Q2) kJ | D.1/2Q2 kJ |
100 g炭粉燃烧所得气体中,CO占 、CO2占
、CO2占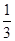 ,且C(s)+
,且C(s)+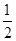 O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+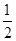 O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
| A.784.92 kJ | B.2 489.44 kJ | C.1 569.83 kJ | D.3 274.3 kJ |
已知化学反应2C(s)+O2(g)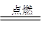 2CO(g)、2CO(g)+O2(g)
2CO(g)、2CO(g)+O2(g)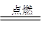 2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )。
| A.12 g C所具有的能量一定高于28 g CO所具有的能量 |
| B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )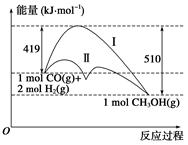
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |