题目内容
14.下列化学式表示的粒子对H2O的电离平衡不产生影响的是( )| A. |  | B. | 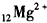 | C. |  | D. | OH- |
分析 水发生电离H2O=H++OH-,酸或碱抑制水电离,弱离子发生水解,所以酸、碱和弱离子都影响水的电离,强酸、强碱根离子不影响水的电离,据此进行判断.
解答 解:水发生电离H2O=H++OH-,酸或碱抑制水电离,弱离子发生水解,所以酸、碱和弱离子都影响水的电离,
A. 为HF,HF溶于水电离出的氢离子抑制水的电离,故A错误;
为HF,HF溶于水电离出的氢离子抑制水的电离,故A错误;
B.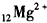 能发生水解促进了水的电离,故B错误;
能发生水解促进了水的电离,故B错误;
C. 是Cl-,是强酸根离子,不发生水解,所以不影响水的电离,故C正确;
是Cl-,是强酸根离子,不发生水解,所以不影响水的电离,故C正确;
D.OH-抑制了水的电离,故D错误;
故选C.
点评 本题考查水化学平衡的影响因素,题目难度中等,明确水电离特点是解本题关键,该物质不发生水解、在水溶液里不都是生成氢离子或氢氧根离子的就不影响水的电离,侧重考查学生综合应用能力.

练习册系列答案
相关题目
2.当今国际能源研究的热点之一是寻找新能源,下列能源不属于新能源的是( )
| A. | 太阳能 | B. | 氢能 | C. | 风能 | D. | 天然气 |
19.下列氧化还原反应中电子转移情况分析正确的是( )
| A. | 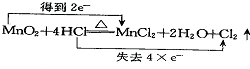 | B. | 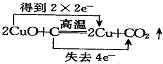 | ||
| C. | 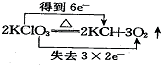 | D. | 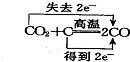 |
6.下列关于电解质的说法中正确的是( )
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO2水溶液的导电性很好,所以SO2是电解质 | |
| C. | 熔融状态时铜的导电性很好,所以铜是电解质 | |
| D. | 硝酸钾在水中和熔融状态时都能导电,所以硝酸钾是电解质 |
3.下列说法不正确的是( )
| A. | 用镊子夹取金属钠固体,切割取用后剩余的钠必须放回原试剂瓶中 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| D. | 在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
4.在一定条件下发生下列反应,少量的物质可以反应完的是( )
| A. | 过量的MnO2和少量的浓HCl | B. | 过量的铜和少量的浓硫酸溶液 | ||
| C. | 过量的氮气和少量的氢气合成氨 | D. | 过量的铁和少量的硝酸 |
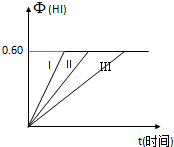 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应: