题目内容
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
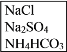
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
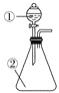
(1)操作①加热的目的是________________,
(2)操作②除用BaCl2溶液外,还可用____________替代。
(3)操作②,判断SO42-已除尽的方法是________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是____________。
(5)操作④的名称是______________,应在________(填仪器名称)中进行。
【答案】加热分解除去NH4HCO3 Ba(OH)2溶液 取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽 除去过量的Ba2+ 减少一次过滤操作 蒸发结晶 蒸发皿
【解析】
(1)化合物中碳酸氢铵受热分解分析;
(2)操作②是沉淀硫酸根离子的作用,也可以加入氢氧化钡溶液,注意不能引入新的杂质;
(3)判断SO42-已除尽选择的试剂是BaCl2溶液;
(4)操作③是除去过量的钡离子;
(5)操作④是蒸发氯化钠溶液得到氯化钠晶体,溶液蒸发在蒸发皿中加热进行。
(1)操作①加热的目的是利用碳酸氢铵受热分解生成氨气、二氧化碳、水蒸气除去碳酸氢铵固体;故答案为:加热分解除去NH4HCO3;
(2)操作②是完全沉淀硫酸根离子,原则是加入的试剂不能引入新的杂质,或最后易于除去,除了用BaCl2溶液外,也可以用Ba(OH)2溶液;
(3)操作②,判断SO42-已除尽的方法是取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽;
(4)操作③是加入碳酸钠溶液,目的是除去过量的钡离子,避免引入钡离子杂质;所以加入碳酸钠的目的是除去过量的Ba2+;不先过滤后再加Na2CO3溶液的理由是减少一次过滤操作;
(5)操作④将溶液蒸发结晶得到溶质晶体;操作④是将氯化钠溶液蒸发结晶得到氯化钠晶体,溶液蒸发应在蒸发皿中加热进行。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
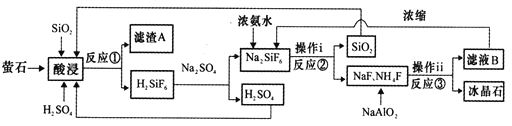
(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式________________,滤渣A的主要成分是_______________________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
实验编号 | 萤石品位 | 硫酸的 | 反应温度/℃ | 获得 Na2SiF6的质量 |
(CaF2含量) | 质量分数 | |||
1 | 96% | 25% | 60~70 | 120 |
2 | 96% | 35% | 60~70 | 153 |
3 | 96% | 35% | 80~90 | 100 |
4 | 96% | 40% | 60~70 | 141 |
①实验3比实验2获得Na2SiF6的质量低的原因可能是___________________。
②选择“酸浸”时所采用的最适合条件为____________________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作ⅰ”不能用硅酸盐质设备进行分离的原因__________________________。
(5)经测定,操作ⅰ所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+___________(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3AlF6)=6.0·10-8)