题目内容
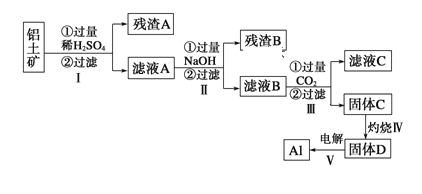
【题目】冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
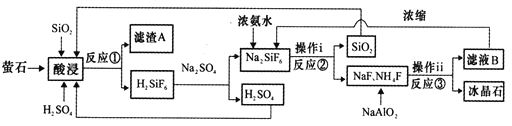
(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式________________,滤渣A的主要成分是_______________________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
实验编号 | 萤石品位 | 硫酸的 | 反应温度/℃ | 获得 Na2SiF6的质量 |
(CaF2含量) | 质量分数 | |||
1 | 96% | 25% | 60~70 | 120 |
2 | 96% | 35% | 60~70 | 153 |
3 | 96% | 35% | 80~90 | 100 |
4 | 96% | 40% | 60~70 | 141 |
①实验3比实验2获得Na2SiF6的质量低的原因可能是___________________。
②选择“酸浸”时所采用的最适合条件为____________________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作ⅰ”不能用硅酸盐质设备进行分离的原因__________________________。
(5)经测定,操作ⅰ所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+___________(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3AlF6)=6.0·10-8)
【答案】 Na+ 硫酸钙 温度过高,HF挥发,造成获得Na2SiF6的质量降低 35%H2SO4、60~70℃ 3Na++4NH4++6F-+AlO2-+2H2O=Na3AlF6↓+4NH3·H2O或3Na++4NH4++6F-+AlO2-=Na3AlF6↓+4NH3++2H2O 滤液中F-水解生成的HF腐蚀硅酸盐质设备 否
【解析】(1)Na3AlF6中氟、铝以共价键结合,Na3AlF6中所含阳离子为钠离子,电子式为Na+;根据图示,反应①是氟化钙、二氧化硅、硫酸反应生成H2SiF4 和 A,因此滤渣为硫酸钙;正确答案: Na+ ; 硫酸钙。
①根据图表信息可知,实验3比实验2获得Na2SiF6的质量低的原因是温度过高,HF挥发,造成获得Na2SiF6的质量降低;正确答案:温度过高,HF挥发,造成获得Na2SiF6的质量降低。
②酸浸的目的是想得到更多的H2SiF4,根据表格,实验2中获得的Na2SiF6的质量最多,选择最适宜的条件为35%H2SO4,控制反应温度60~70℃ 之间;正确答案:35%H2SO4、60~70℃ 。
(3)根据流程图可知,反应③中,氟化钠、氟化铵和偏铝酸钠反应生成Na3AlF6和一水合氨,反应的离子方程式:3Na++4NH4++6F-+AlO2-+2H2O=Na3AlF6↓+4NH3·H2O或3Na++4NH4++6F-+AlO2-=Na3AlF6↓+4NH3+2H2O;正确答案:3Na++4NH4++6F-+AlO2-+2H2O=Na3AlF6↓+4NH3·H2O或3Na++4NH4++6F-+AlO2-=Na3AlF6↓+4NH3+2H2O。
(4)滤液中含有氟离子,能够发生水解生成氢氟酸,氢氟酸能够与硅酸盐质设备反应;正确答案:滤液中F-水解生成的HF腐蚀硅酸盐质设备。
(5)根据Ksp(Na3AlF6)=c(Na+)×c(AlF-6)= 4.0×10-10,当c(Na+)=0.01mol·L-1时,c(AlF-6)= 4.0×10-8,QC= c(K +)×c(AlF-6)= 0.05×4.0×10-8=2×10-9< Ksp(K3AlF6)=6.0×10-8,所以K+没有开始沉淀;正确答案:否。

 阅读快车系列答案
阅读快车系列答案【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的1/3Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________________________。
当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性状 | 磁性大小 |
1:3 | 红棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为________________________。
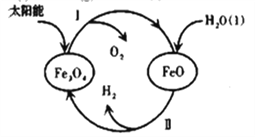
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程Ⅰ的热化学方程式。
过程Ⅰ:________________________________,
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①T℃时,10min内用Fe3O4表示的平均反应速率为_____g·min-1。
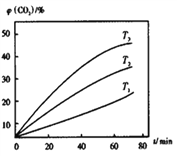
②其他条件不变时,该反应在不同温度下,CO2含量随时间的变化φ(CO2)-t曲线如图所示,温度T1、T2、T3由大到小的关系是_________________,判断依据是___________________。