��Ŀ����
����Ŀ�����Ȼ�������ýȾ�����л��ϳ��ϵ��Ȼ���������ˮ���Ȼ�����¶�ڿ�����������е�ˮ�ַ�Ӧ���ɰ�ɫ��������ǿ�ҵĴ̼�����ζ��ʵ����������װ��ģ��ϳ����Ȼ��������Ƚ����������ڣ�Ȼ��������ˮ���Ƴ���������������������뷴Ӧ��B�У�����Ӧ���л���ͨ�����������
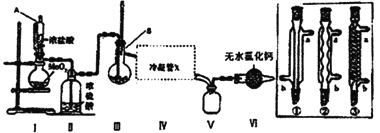
�����ּг�װ�ü���������ʡ�ԣ�
���������������£�
���� | ״̬ | �۵�/�� | �е�/�� |
Sn | ����ɫ���� | 232 | 2260 |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | -33 | 114 |
�ش��������⣺
��1������A������Ϊ_____________________������������Ӧѡ��________________________��
��2��װ��I�з�����Ӧ�����ӷ���ʽΪ______________________________��
��3��SnCl4�ڿ�������ˮ������Ӧ���ɰ�ɫSnO2��xH2O���壬�䷴Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4����װ�ô��ڵ�ȱ����_________________________��
��5������˵����ȷ����__________��
A.������Ӧ��ȼ�ƾ����ٵ�ȼ�ƾ���
B.����������������Ŀ����ҪΪ�����ѧ��Ӧ����
C.��ʵ��Ӧ����ͨ����ڻ���ͨ��ĵط�����
D.����Ʒ�������ᣬ������ˮ��⣬����ˮ��ɫ��ȥ��˵��SnCl4�к���SnCl2
E.����Ӧע���ڼ���֮ǰ�Ƚ�ͨ��ȴˮ����ֹͣ���Ⱥ���Ҫ����ͨ��ȴˮһ��ʱ��
��6����Ʒ�к�����SnCl2���ⶨSnCl4���ȵķ�����ȡ0.200g��Ʒ����50mL��ϡ�����У����������Һ��ָʾ������0.0100mol/L����ر���Һ�ζ����յ㣬���ı�Һ4.00 mL����Ӧԭ��Ϊ��3SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O���жϵζ��յ������Ϊ_____________����Ʒ�Ĵ���Ϊ________��
���𰸡� ��ѹ©�����Һ©�� �� 2MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O SnCl4+(x+2)H2O=SnO2��xH2O+4HCl ȱ��β������װ�� BCDE ���������һ�α�Һ����Һ������ɫ�Ұ���Ӳ���ɫ 88.6%
Mn2++Cl2��+2H2O SnCl4+(x+2)H2O=SnO2��xH2O+4HCl ȱ��β������װ�� BCDE ���������һ�α�Һ����Һ������ɫ�Ұ���Ӳ���ɫ 88.6%
��������(1)����װ��ͼ������AΪ��ѹ©��������������Ӧѡ��ֱ�������ܣ��ʴ�Ϊ����ѹ©��������
(2)װ��I�ж���������Ũ���ᷴӦ������������Ӧ�����ӷ���ʽΪ2MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O���ʴ�Ϊ��2MnO2+4H++2Cl-
Mn2++Cl2��+2H2O���ʴ�Ϊ��2MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(3)SnCl4�ڿ�������ˮ������Ӧ���ɰ�ɫSnO2��xH2O���壬��Ӧ�Ļ�ѧ����ʽΪSnCl4+(x+2)H2O=SnO2��xH2O+4HCl���ʴ�Ϊ��SnCl4+(x+2)H2O=SnO2��xH2O+4HCl��
(4)��Ӧ���õ�����������Ⱦ������Ӧ��ʹ��ʢ������������Һ��β������װ�����ն�����������ʴ�Ϊ��ȱ��β������װ�ã�
(5)A.���ܹ���������Ӧ����Ҫ�������ų�װ���еĿ�����������Ӧ��ȼ�ƾ����ٵ�ȼ�ƾ��ƣ���A����B.�������������������˽Ӵ�������������ѧ��Ӧ���ʣ���B��ȷ��C.ʵ����ʹ��������������Ⱦ������Ӧ����ͨ����ڻ���ͨ��ĵط����У���C��ȷ��D.����Ʒ�������ᣬ��SnCl4�к���SnCl2����ˮ�ܹ���SnCl2������ʹ����ˮ��ɫ��ȥ����D��ȷ��E.Ϊ�˷�ֹը�������ܣ�����Ӧע���ڼ���֮ǰ�Ƚ�ͨ��ȴˮ����ֹͣ���Ⱥ���Ҫ����ͨ��ȴˮһ��ʱ�䣬��E��ȷ����ѡBCDE��
(6)��Ӧԭ��Ϊ��3SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O��һ��SnCl2��Ӧ��ȫ��KIO3�ὫKI�������ɵⵥ�ʣ���Һ�����ɫ����˵��������һ�α�Һ����Һ������ɫ�Ұ���Ӳ���ɫ��˵���ﵽ�˵ζ��յ㣻n(KIO3)=0.004L��0.0100mol/L=0.00004mol����n(SnCl2)=3 n(KIO3)= 0.00004mol��3=0.00012mol����Ʒ�Ĵ���=![]() ��100%=88.6%���ʴ�Ϊ��88.6%��
��100%=88.6%���ʴ�Ϊ��88.6%��

����Ŀ��I.������CO2����������ᵼ�µ�������¶�����������̬�����ı䡣
��֪��CO2(g)+CaO(s)![]() CaCO3 (s)
CaCO3 (s)
(1) ij�о�С����ʵ����̽����ͬ�¶ȶ�CaO����CO2Ч�ʵ�Ӱ�졣�������ͬ���ܱ������У�������һ��������ʯ�Һ�����CO2���ڲ�ͬ�¶��£�����������ʼʵ���������䣬��������ƽ��ֱ���t��ʱ�ⶨCO2��Ũ��(mol/L) ��ͼ��
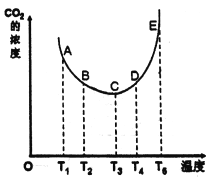
�ٸ÷�Ӧ��__________���������Է����С�
A.�ϸ��¶� B.�ϵ��¶� C.�κ��¶� D.�κ��¶��¾�����
��A��B��C��D��E����У��ﵽ��ѧƽ��״̬�ĵ���_____________��
��2���ں㶨�¶��£�һ������̶�Ϊ1L�������м���20gCaO��һ������CO2���壬��10���Ӵ�ƽ��Ĺ�����CO2Ũ�ȱ仯��ͼ��ʾ��Ϊ���CO2�������ʣ����п��Բ�ȡ�Ĵ�ʩ��__________��
A.��С��Ӧ�������ݻ� B.�����¶�
C.ƽ����ϵ�м�ʱ���������CaCO3 D.ʹ�ú��ʵĴ���
������ƽ��ʱ���¶Ȳ��䣬15����ʱ�����Ѹ��������2L����20����ʱ���´ﵽƽ�⣬������ͼ�в�������仯��CO2Ũ�ȱ仯ʾ��ͼ_______��

��.���ݻ��ɱ���ܱ������з�����Ӧ��mA(g)+nB(g)![]() pC(g),��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�
pC(g),��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�
ѹǿp/Pa | 2��105 | 5��105 | 1��106 |
c(A)mol��L-1 | 0.08 | 0.20 | 0.44 |
��3����ѹǿΪ1��106Paʱ���˷�Ӧ��ƽ�ⳣ������ʽ��_________________________��
��4���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������ͼ�Ǹ÷���������ˮ��ʵ��װ��ʾ��ͼ��ʵ������У���ˮ��pHʼ�ձ�����5.0-6.0֮�䡣��ͨ��Դ���������������彫�������ˮ���γɸ�������ȥ����ѡ�������ã����������ij������������ԣ���������������������۾������á�
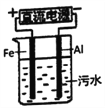
���������ɳ������ܵ缫��ӦΪ��___________________________________��

