题目内容
转炉炼钢过程中既被氧化又被还原的元素是
| A.铁 | B.氮 | C.氧 | D.碳 |
D
解析试题分析:根据 可知高炉炼铁基本原理:物料从炉顶进入,从炉底出去,因炉渣密度较小,所以出铁口在最下方,其次是出渣口,从炉低进热空气,上方下来的焦炭在炉底部进风口附近首先反应生成二氧化碳.然后二氧化碳随气流上升与焦炭进一步反应生成一氧化碳;最后一氧化碳与铁矿石反应还原出铁,有关反应的化学方程式是C+O2
可知高炉炼铁基本原理:物料从炉顶进入,从炉底出去,因炉渣密度较小,所以出铁口在最下方,其次是出渣口,从炉低进热空气,上方下来的焦炭在炉底部进风口附近首先反应生成二氧化碳.然后二氧化碳随气流上升与焦炭进一步反应生成一氧化碳;最后一氧化碳与铁矿石反应还原出铁,有关反应的化学方程式是C+O2 CO2、CO2+C
CO2、CO2+C 2CO、 Fe2O3+3CO
2CO、 Fe2O3+3CO 2Fe+3CO2,即炼铁反应中铁元素被还原剂CO还原,氮元素没有参与氧化还原反应,氧元素被碳还原,碳元素发生C→CO2→CO的一系列反应中,既被氧化又被还原,答案选D。
2Fe+3CO2,即炼铁反应中铁元素被还原剂CO还原,氮元素没有参与氧化还原反应,氧元素被碳还原,碳元素发生C→CO2→CO的一系列反应中,既被氧化又被还原,答案选D。
考点:考查炼铁原理的有关判断

二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是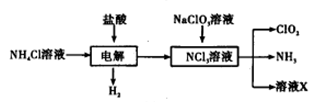
A.电解时发生反应的化学方程式为: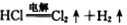 |
| B.由NaClO3溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的成分为NaClO3和NaOH |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )
| A.①③ | B.③④ | C.①② | D.①④ |
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
下列工业生产的主要反应原理不涉及氧化还原反应的是
| A.硝酸工业 | B.接触法制硫酸 | C.合成氨工业 | D.氨碱法制纯碱 |
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫 |
氧化还原反应是重要的反应类型,下列有关说法正确的是
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。