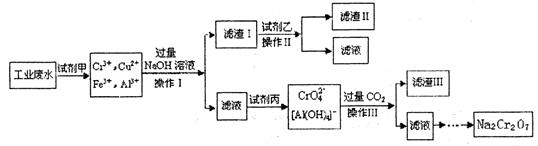
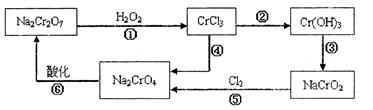
题目内容
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
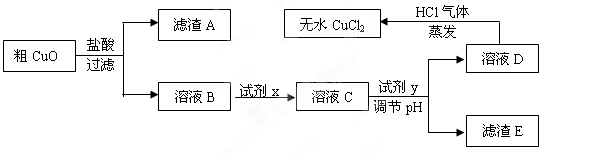 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH= 。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是 (填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为 。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是 (填以下选项序号),原因是 。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于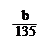 mol
mol
C.粗CuO中所含的铜元素的质量分数为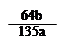 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH= 。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是 (填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为 。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是 (填以下选项序号),原因是 。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于

B.粗CuO中CuO物质的量小于
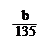 mol
molC.粗CuO中所含的铜元素的质量分数为
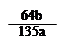 ×100℅
×100℅ D.粗CuO中关于CuO的量无法确定
(1)3(2分) (2)HCl抑制CuCl2水解(1分)
(3)BD(2分) 2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)A(2分) 将引入新杂质NaCl(1分) (5)ABD(3分)
(3)BD(2分) 2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)A(2分) 将引入新杂质NaCl(1分) (5)ABD(3分)
(1)根据Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38可知,当溶液中的Fe3+物质的量的浓度=10-5mol/L时,溶液中c(OH-)= ,所以溶液的pH=3。
,所以溶液的pH=3。
(2)氯化铜时强酸弱碱盐,水解显酸性,加热促进水解,所以为防止铜离子水解,需要在在HCl气体中蒸干。
(3)除去亚铁离子,需要加入氧化剂,但不能引入新的杂质,氯气的还原产物是氯离子,臭氧的还原产物是水,不会带入杂质,BD正确。AC会引入杂化离子锰离子和钠离子等,不正确。答案选BD。双氧水的还原产物是水,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(4)y是消耗氢离子,来调节溶液的pH,但不能引入杂质,氢氧化钠能带入杂质离子钠离子,所以不能选择A,其余都是正确的,答案选A。
(5)由于粗氧化铜中含有杂质,所以氧化铜的物质的量小于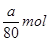 ,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。
,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。
 ,所以溶液的pH=3。
,所以溶液的pH=3。(2)氯化铜时强酸弱碱盐,水解显酸性,加热促进水解,所以为防止铜离子水解,需要在在HCl气体中蒸干。
(3)除去亚铁离子,需要加入氧化剂,但不能引入新的杂质,氯气的还原产物是氯离子,臭氧的还原产物是水,不会带入杂质,BD正确。AC会引入杂化离子锰离子和钠离子等,不正确。答案选BD。双氧水的还原产物是水,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(4)y是消耗氢离子,来调节溶液的pH,但不能引入杂质,氢氧化钠能带入杂质离子钠离子,所以不能选择A,其余都是正确的,答案选A。
(5)由于粗氧化铜中含有杂质,所以氧化铜的物质的量小于
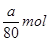 ,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。
,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。
练习册系列答案
相关题目
 可能增大也可能减小
可能增大也可能减小