题目内容
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( ) 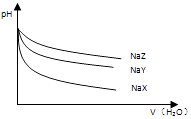
A.在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z﹣)>c(Y﹣)>c(X﹣)
C.在上述NaX和NaY的混合液中存在 ![]() =
= ![]()
D.在0.2molL﹣1 NaX溶液中加 入等体积0.1molL﹣1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH﹣)+c(Cl﹣)
【答案】D
【解析】解:由图象可以看出,pH相同的NaX、NaY和NaZ溶液,稀释后pH的变化程度不相同,因此可以判断NaX、NaY、NaZ的浓度不同,由于NaZ的pH变化最小,说明NaZ的浓度最大且弱酸根Z﹣的水解程度最小,X﹣的水解程度最大,注意这里需要和等浓度的NaX、NaY、NaZ三种盐溶液的比较进行区分,如果是等浓度的话,那么pH变化最大的应该是水解程度最小的.
A.由于三种盐溶液pH相同,因此对水的电离的促进作用是相同的,所以NaX、NaY和NaZ溶液中水的电离度大小是相同的,故A错误;
B.等物质的量浓度的NaX、NaY、NaZ混合液中,酸根离子水解程度越大,其溶液中酸根离子浓度越小,所以离子浓度的大小关系是c(Z﹣)<c(Y﹣)<c(X﹣),故B错误;
C.在 ![]() 可表示X﹣水解的百分含量或水解程度,
可表示X﹣水解的百分含量或水解程度, ![]() 可表示Y﹣水解的百分含量或水解程度,而X﹣和Y﹣的水解程度是不相同的,所以两者不相等,故C错误;
可表示Y﹣水解的百分含量或水解程度,而X﹣和Y﹣的水解程度是不相同的,所以两者不相等,故C错误;
D.在0.2molL﹣1 NaX溶液中加入等体积0.1molL﹣1的盐酸反应后溶液中的溶质是等物质的量浓度的NaX、NaCl、HX,根据电荷守恒得c(H+)+c(Na+)=c(OH﹣)+c(Cl﹣)+c(X﹣),根据物料守恒得c(Na+)=c(HX)+c(X﹣)=2c(Cl﹣),所以得c(H+)+c(HX)=c(OH﹣)+c(Cl﹣),故D正确;
故选D.

【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2