题目内容
【题目】连二次硝酸(H2N2O2)是二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为___。
(2)常温下,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
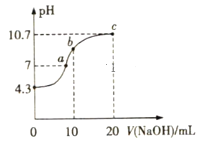
写出H2N2O2在水溶液中电离的主要方程式:___。
②c点时溶液中下列离子Na+、OH-、N2O22-、HN2O2-,浓度由大到小的顺序为___。
③b点时溶液中的溶质为___。
④a点时溶液中c(Na+)___c(HN2O2-)+c(N2O22-)(填“>”“<”或“=”)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可得到黄色的连二次硝酸银沉淀,向该体系中滴加硫酸钠溶液,白色沉淀和黄色沉淀共存时,该体系中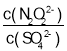 =___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
=___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
【答案】+1 H2N2O2![]() HN2O2-+ H+ c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-) NaHN2O2 > 3.0×10-4
HN2O2-+ H+ c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-) NaHN2O2 > 3.0×10-4
【解析】
连二次硝酸(H2N2O2)是二元酸,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,消耗10mLNaOH时,溶质为NaHN2O2,即b点溶质为:NaHN2O2,消耗20mLNaOH时,溶质为Na2N2O2,即c点溶质为:Na2N2O2。
![]() 分子中H的化合价为
分子中H的化合价为![]() ,O元素的化合价为
,O元素的化合价为![]() ,设N元素的化合价为x,根据总化合价之和为0可知:
,设N元素的化合价为x,根据总化合价之和为0可知:![]() ,解得:
,解得:![]() ,即N元素的化合价为
,即N元素的化合价为![]() ,故答案为:
,故答案为:![]() ;
;![]() 由分析和滴定曲线可知,c点溶质为:Na2N2O2,显碱性,说明N2O22-会水解,
由分析和滴定曲线可知,c点溶质为:Na2N2O2,显碱性,说明N2O22-会水解,![]() 为二元弱酸,在水溶液中的电离方程式为:
为二元弱酸,在水溶液中的电离方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 点滴入20mL相同浓度的NaOH溶液,反应后溶质为
点滴入20mL相同浓度的NaOH溶液,反应后溶质为![]() ,所以
,所以![]() 部分水解产生
部分水解产生![]() :
:![]() +H2O
+H2O![]()
![]() +OH-,由于
+OH-,由于![]() 还要水解产生OH-,所以
还要水解产生OH-,所以![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 由上面分析可知,b点溶质为NaHN2O2,故答案为:NaHN2O2;
由上面分析可知,b点溶质为NaHN2O2,故答案为:NaHN2O2;
④溶液中的电荷守恒式子为:c(Na+)+c(H+)=c(HN2O2-)+2c(N2O22-)+c(OH-),a点pH=7,溶液显中性,有c(H+)= c(OH-),所以c(Na+)=c(HN2O2-)+2c(N2O22-),所以c(Na+)>c(HN2O2-)+c(N2O22-),故答案为:>;
![]() 当两种沉淀共存时,溶液中存在两种沉淀溶解平衡,所以
当两种沉淀共存时,溶液中存在两种沉淀溶解平衡,所以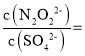
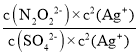 =
=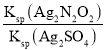
![]() ,故答案为:
,故答案为:![]() 。
。