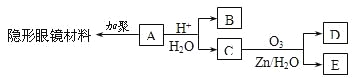
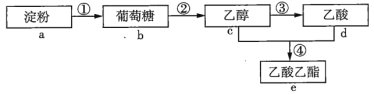
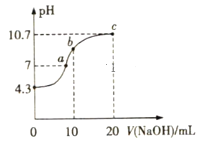
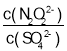题目内容
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.每生成1molN2H4转移2mol电子
C.室温下,向0.1mol·L-1NaClO溶液中加水,溶液pH减少
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为N2H4-4e-=N2+4H+
【答案】BC
【解析】
2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)是气体分子数减少的反应,熵减,ΔS<0,常温下能自发进行,说明ΔH- TΔS<0,因为ΔS<0,所以- TΔS﹥0,那么ΔH<0。
A.由分析可知ΔH<0,ΔS<0,A错误;
B.N化合价从-3升高到-2,升高1,共2个N原子化合价升高,共升高2,Cl化合价从+1降到-1,降低了2,所以,每生成1molN2H4转移2mol电子,B正确;
C.ClO-水解显碱性:![]() ,加水稀释,OH-浓度减小,碱性减弱,pH减小,C正确;
,加水稀释,OH-浓度减小,碱性减弱,pH减小,C正确;
D.燃料电池,燃料在负极失电子,发生氧化反应,在碱性电解质中,该燃料电池负极反应为:N2H4+4OH--4e-= N2+4H2O,D错误。
答案选BC。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目