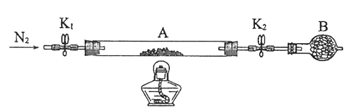
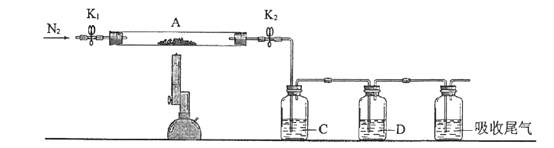
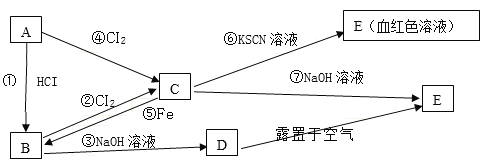
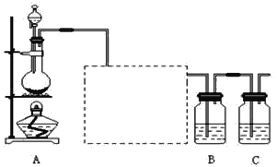
题目内容
【题目】某同学帮助水质检测站配制480 mL0.5mol·L- NaOH溶液以备使用。
(1)该同学应选择_______mL的容量瓶。
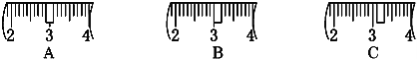
(2)该同学应称取NaOH固体_______g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______ (填字母),并在下图中选出能正确表示游码位置的选项_______(填字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(3)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或无影响,下同)
②容量瓶中原来有少量蒸馏水,浓度会_____。
(4)完成以下氧化还原反应的离子方程式:
______MnO![]() +______C2O
+______C2O![]() +______=_______Mn2++_______CO2↑+________。
+______=_______Mn2++_______CO2↑+________。
【答案】 500 10.0 cd C 偏小 无影响 2 5 16H+ 2 10 8H2O
【解析】(1)实验室没有480mL的容量瓶,大于480mL且规格相近的容量瓶,故应选500mL容量瓶,故答案为:500;
(2)配制500mL0.5molL-1NaOH溶液需要氢氧化钠的质量为0.5L×0.5mol/L×40g/mol=10.0g;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,即选择cd;由表中数据可知,最小的砝码为5g,故游码的最大刻度为5g,故小于5g使用游码,所以游码应在3.1g的位置,故选择C,故答案为:10.0;cd;C;
(3)①转移完溶液后未洗涤玻璃棒和烧杯,玻璃棒、烧杯壁上沾有少量的氢氧化钠,移入容量瓶内的氢氧化钠的质量减少,所配溶液的浓度偏小,故答案为:偏小;
②溶液配制需加水定容,容量瓶中原来有少量蒸馏水,对所配溶液浓度无影响,故答案为:无影响;
(4)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,由电子守恒可知2MnO4-+5C2O42-+____→2Mn2++10CO2↑+___,由电荷守恒可知2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+____,由原子守恒可知2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,故答案为:2;5;16H+;2;10;8H2O。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】己知镍的金属活动性介于铁和锡之间。工业上以氧化镍矿为原料制取高纯度的金属镍,最适宜的方法是
A. 氧化镍高温分解 B. 电解熔融的氧化镍
C. 高温下用焦炭还原氧化镍 D. 高温下用氢气还原氧化镍
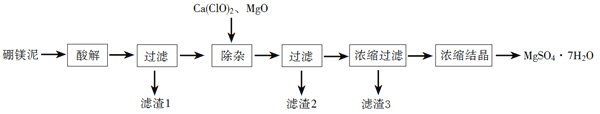
【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。