题目内容
【题目】氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产中通过电解饱和食盐水获取大量氯气,化学方程式为________________。
(2)氯气可用于制取“84”消毒液(有效成分为NaClO),离子方程式为_______________。
【答案】 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cl2+2OH-===Cl-+ClO-+H2O
2NaOH+H2↑+Cl2↑ Cl2+2OH-===Cl-+ClO-+H2O
【解析】(1)工业生产中通过电解饱和食盐水获取大量氯气,同时还有氢气和氢氧化钠产生,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。(2)氯气与氢氧化钠溶液反应可知制取“84”消毒液(有效成分为NaClO),离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
2NaOH+H2↑+Cl2↑。(2)氯气与氢氧化钠溶液反应可知制取“84”消毒液(有效成分为NaClO),离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

练习册系列答案
相关题目
【题目】某同学帮助水质检测站配制480 mL0.5mol·L- NaOH溶液以备使用。
(1)该同学应选择_______mL的容量瓶。
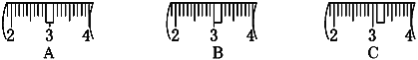
(2)该同学应称取NaOH固体_______g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______ (填字母),并在下图中选出能正确表示游码位置的选项_______(填字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(3)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或无影响,下同)
②容量瓶中原来有少量蒸馏水,浓度会_____。
(4)完成以下氧化还原反应的离子方程式:
______MnO![]() +______C2O
+______C2O![]() +______=_______Mn2++_______CO2↑+________。
+______=_______Mn2++_______CO2↑+________。