题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是_____________(填名称)。
(2)画出虚线框内的实验装置图,并注明所加试剂。_________
(3)装置B中盛放的试剂是_________(填字母)。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
实验现象为___________________,化学反应方程式为_________________________。
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举两例):_______________________、____________。
【答案】 浓盐酸  A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ HCl的稳定性比H2S的稳定性强 HClO4的酸性比H2SO4的酸性强
A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ HCl的稳定性比H2S的稳定性强 HClO4的酸性比H2SO4的酸性强
【解析】(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2;(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中又挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度;(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓;(4)非金属性越强,氢化物越稳定,最高价含氧酸的酸性越强,因此HCl的稳定性比H2S的稳定性强以及HClO4的酸性比H2SO4的酸性强均可以说明氯元素非金属性强于硫元素。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】某同学帮助水质检测站配制480 mL0.5mol·L- NaOH溶液以备使用。
(1)该同学应选择_______mL的容量瓶。
(2)该同学应称取NaOH固体_______g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______ (填字母),并在下图中选出能正确表示游码位置的选项_______(填字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
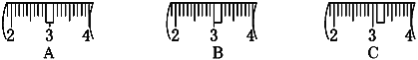
(3)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会_____(填“偏大”、“偏小”或无影响,下同)
②容量瓶中原来有少量蒸馏水,浓度会_____。
(4)完成以下氧化还原反应的离子方程式:
______MnO![]() +______C2O
+______C2O![]() +______=_______Mn2++_______CO2↑+________。
+______=_______Mn2++_______CO2↑+________。



