题目内容
17.取a g某铁的氧化物R溶于足量的盐酸中,加水稀释至200mL,取20mL所得溶液,向其中滴加新制的氯水,将其中的铁元素全部氧化为Fe3+,再向溶液中加入NaOH溶液使其完全沉淀,所得沉淀经过过滤、洗涤,并将沉淀灼烧至质量不再改变,称量得b g固体,则下列判断正确的是( )| A. | 若a:b=9:1,则R的化学式为FeO | |
| B. | 若a:b=1:10,则R的化学式为Fe2O3 | |
| C. | 若a:b=29:30,则R的化学式为Fe3O4 | |
| D. | 试验过程中被还原的Cl2为(10b-a)/8mol |
分析 20mL溶液相当于溶解铁的氧化物整理ag×$\frac{20mL}{200mL}$=0.1a,灼烧最终得到bg固体为Fe2O3,令原Fe氧化物的物质的量为n mol,根据Fe元素守恒计算氧化铁的物质的量,根据m=nM表示选项中各氧化物的质量、氧化铁的质量,进而确定a:b的关系,据此验证判断;
最终得到氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,据此计算通入氯气的物质的量.
解答 解:20mL溶液相当于溶解铁的氧化物ag×$\frac{20mL}{200mL}$=0.1a,
A.若R的化学式为FeO,经过系列变化又得到Fe2O3,设0.1a g FeO的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=0.5n mol,则:72n=0.1a,160×0.5n=b,整理的a:b=9:1,故A正确;
B.若R的化学式为Fe2O3,经过系列变化又得到到Fe2O3,则:0.1a=b,故a:b=10:1,故B错误;
C.若R的化学式为Fe3O4,经过系列变化又得到Fe2O3,设0.1a g Fe3O4的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=$\frac{3n}{2}$mol,则:232n=0.1a,160×$\frac{3n}{2}$=b,整理的a:b=29:3,故C错误;
D.最终氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,而1mol氯气获得的电子等于1molO原子获得的电子,故被还原氯气物质的量=n(O)=$\frac{(b-a)g}{16g/mol}$=$\frac{10b-a}{16}$mol,故D错误,
故选A.
点评 本题考查化学计算,侧重考查学生分析解决问题的能力,利用验证法进行判断比较简单,也可以计算铁氧化物中Fe、O质量确定化学式,但比较麻烦,D选项为易错点,注意根据电子转移守恒解答.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案①棕红色NO2加压后颜色先变深后变浅
②Fe(SCN)3溶液中加入固体KSCN后颜色变深
③氯水宜保存在低温、避光条件下
④SO2催化氧化成SO3的反应,往往加入过量的空气.
| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
| A. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| B. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| C. | 17gNH3所含电子数目为NA | |
| D. | 22.4LHCl溶于水,溶液中H+数为NA |
| A. | 50 mL 0.1 mol/L的NaCl溶液 | B. | 100 mL 0.2 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 10 mL 0.5 mol/L的Na2CO3溶液 |
| A. | 硫酸工业生产过程在接触室中运用热交换技术可充分利用能源 | |
| B. | 联合制碱法生产纯碱时,先通入二氧化碳,再通入氨气 | |
| C. | 氯碱工业是以利用电解食盐水生产氯气、氢气和氢氧化钠为基础的工业体系 | |
| D. | 合成氨工业汇总,加入催化剂可提高氢气的转化率 |
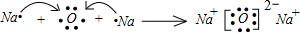 .
.
 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 2,4,4,5-四甲基庚烷
2,4,4,5-四甲基庚烷 2-戊烯
2-戊烯