题目内容
9.下列说法正确的是( )| A. | 硫酸工业生产过程在接触室中运用热交换技术可充分利用能源 | |
| B. | 联合制碱法生产纯碱时,先通入二氧化碳,再通入氨气 | |
| C. | 氯碱工业是以利用电解食盐水生产氯气、氢气和氢氧化钠为基础的工业体系 | |
| D. | 合成氨工业汇总,加入催化剂可提高氢气的转化率 |
分析 A、使用热交换装置可节约能源;
B、联合制碱生成产纯碱时,先通氨气,再通入二氧化碳;
C、氯碱工业就是通过电解饱和食盐水生成氯气、氢气和氢氧化钠;
D、催化剂能加快反应速率,但不影响平衡的移动.
解答 解:A、二氧化硫被氧化为三氧化硫是放热反应,使用热交换装置热量,充分利用可节约能源;故A正确;
B、侯氏制碱法的原理就是向饱和的氯化钠溶液里,先通氨气至饱和,再通过量二氧化碳,这样可以保证在碱性条件下生成更多的HCO3-;故B错误;
C、工业上通过电解饱和食盐水制得氯气、氢气和氢氧化钠,称为“氯碱工业”;故C正确;
D、合成氨工业为加快反应速率可加入催化剂,但因使用催化剂不改变平衡的移动,也就无法改变氢气的转化率;故D错误;
故选:A、C.
点评 考查常见的化工生产,包括硫酸工业、氯碱工业、侯氏制碱法及合成氨,基础题,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
19.表中“实验操作”与“预期现象”对应关系正确的是( )
| 选项 | 实验操作 | 预期现象 |
| A | 向AlCl3溶液中滴入过量的氨水 | 先有白色沉淀,后沉淀消失 |
| B | 向AgCl浊液中滴入KI溶液,振荡 | 白色浑浊逐渐转化为黑色沉淀 |
| C | 向Ca(ClO)2溶液中通入CO2,再滴入少量品红溶液 | 出现浑浊,滴入的品红变无色 |
| D | 向BaCl2溶液中先通入SO2,再通入NO2 | 先有白色沉淀,后沉淀消失 |
| A. | A | B. | B | C. | C | D. | D |
17.取a g某铁的氧化物R溶于足量的盐酸中,加水稀释至200mL,取20mL所得溶液,向其中滴加新制的氯水,将其中的铁元素全部氧化为Fe3+,再向溶液中加入NaOH溶液使其完全沉淀,所得沉淀经过过滤、洗涤,并将沉淀灼烧至质量不再改变,称量得b g固体,则下列判断正确的是( )
| A. | 若a:b=9:1,则R的化学式为FeO | |
| B. | 若a:b=1:10,则R的化学式为Fe2O3 | |
| C. | 若a:b=29:30,则R的化学式为Fe3O4 | |
| D. | 试验过程中被还原的Cl2为(10b-a)/8mol |
14.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(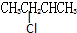 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 邻羟基苯甲酸与NaHCO3溶液反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
1.下列哪种说法可以证明反应.N2+3H2?2NH3已达到平衡状态( )
| A. | 1个N≡N键断裂的同时,有6个H-H键断裂 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个N-H键形成 |
18.由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性.以下各组粒子结构不相似的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
19.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA | |
| B. | 常温常压下,2NA 个CO2分子占有的体积为44.8L | |
| C. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA |