题目内容
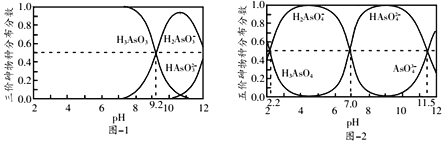
【题目】室温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示。
下列说法错误的是( )
A. H3AsO3和Na2HAsO4水溶液可以发生复分解反应
B. H3AsO4水溶液中存在:![]()
C. 向 H3AsO4的溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 室温下向含0.2mol H3AsO4的溶液中加入12gNaOH固体,所得溶液的pH=7
【答案】A
【解析】
A,由图-1可推知Ka1(H3AsO3)=![]() =10-9.2,由图-2可推知Ka2(H3AsO4)=
=10-9.2,由图-2可推知Ka2(H3AsO4)=![]() =10-7.0
=10-7.0![]() 10-9.2,酸性H2AsO4-
10-9.2,酸性H2AsO4-![]() H3AsO3,H3AsO3和Na2HAsO4水溶液不能发生复分解反应,A项错误;B,H3AsO4溶液中存在电离平衡:H3AsO4
H3AsO3,H3AsO3和Na2HAsO4水溶液不能发生复分解反应,A项错误;B,H3AsO4溶液中存在电离平衡:H3AsO4![]() H++H2AsO4-、H2AsO4-
H++H2AsO4-、H2AsO4-![]() H++HAsO42-、HAsO42-
H++HAsO42-、HAsO42-![]() H++AsO43-,H2O
H++AsO43-,H2O![]() H++OH-,溶液中的电荷守恒为c(H+)=c(OH-)+c(H2AsO4-)+2c(HAsO42-)+3c(AsO43-),B项正确;C,由图-2推知Ka1(H3AsO4)=
H++OH-,溶液中的电荷守恒为c(H+)=c(OH-)+c(H2AsO4-)+2c(HAsO42-)+3c(AsO43-),B项正确;C,由图-2推知Ka1(H3AsO4)= ![]() =10-2.2,Ka2(H3AsO4)=
=10-2.2,Ka2(H3AsO4)= ![]() =10-7.0,Ka1(H3AsO4)·Ka2(H3AsO4)=
=10-7.0,Ka1(H3AsO4)·Ka2(H3AsO4)=![]() =10-9.2,
=10-9.2,![]() =10-9.2
=10-9.2![]() c2(H+)=10-9.2
c2(H+)=10-9.2![]() (10-5)2=100.8,C项正确;D,n(NaOH)=
(10-5)2=100.8,C项正确;D,n(NaOH)=![]() =0.3mol,n(H3AsO4):n(NaOH)=0.2mol:0.3mol=2:3,H3AsO4与NaOH恰好完全反应生成物质的量都等于0.1molNaH2AsO4和Na2HAsO4,由图像知H2AsO4-和HAsO42-相等时pH=7,D项正确;答案选A。
=0.3mol,n(H3AsO4):n(NaOH)=0.2mol:0.3mol=2:3,H3AsO4与NaOH恰好完全反应生成物质的量都等于0.1molNaH2AsO4和Na2HAsO4,由图像知H2AsO4-和HAsO42-相等时pH=7,D项正确;答案选A。