题目内容
【题目】某校化学研究性学习小组的同学在学习了氨的性质讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验室制取氨气的化学方程式______________________;
(2)在实验室中,还可以用浓氨水与______(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的?_______(填“能”或“否”),理由是_____________________ 。
(4)检验铵盐中的阳离子时,取少量铵盐于试管中,____________则证明铵盐中有该NH4+离子。反应的离子方程式______________________。
【答案】 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O CaO(或NaOH固体或碱石灰均可) 否 NH3极易溶于水 加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成 NH4++OH-
CaCl2+2NH3↑+2H2O CaO(或NaOH固体或碱石灰均可) 否 NH3极易溶于水 加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成 NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【解析】(1)实验室利用氯化铵与消石灰在加热的条件下制取氨气,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;(2)浓氨水中存在:NH3+H2O
CaCl2+2NH3↑+2H2O;(2)浓氨水中存在:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使反应逆向移动,同时反应放热,促进NH3·H2O的分解,从而可以快速的制备少量氨气。(3)由于NH3极易溶于水,所以不能用排饱和氯化铵溶液的方法收集氨气。(4)铵盐能与强碱反应放出碱性气体氨气,则检验铵盐中的阳离子时,可以取少量铵盐于试管中,加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成,则证明铵盐中有NH4+离子,反应的离子方程式为NH4++OH-
NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使反应逆向移动,同时反应放热,促进NH3·H2O的分解,从而可以快速的制备少量氨气。(3)由于NH3极易溶于水,所以不能用排饱和氯化铵溶液的方法收集氨气。(4)铵盐能与强碱反应放出碱性气体氨气,则检验铵盐中的阳离子时,可以取少量铵盐于试管中,加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成,则证明铵盐中有NH4+离子,反应的离子方程式为NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是
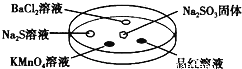
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D