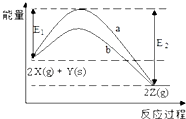
题目内容
【题目】下列各组离子在强碱性溶液中一定能大量共存的是( )
A. Na+、NH4+、SO42-B. Ag+、Fe3+、Cl-
C. Ba2+、K+、NO3-D. K+、Ba2+、HCO3-
【答案】C
【解析】
A.在强碱性溶液中OH-与NH4+会发生离子反应,产生弱电解质NH3·H2O,不能大量共存,A错误;
B.在强碱性溶液中OH-与Ag+、Fe3+会发生离子反应,不能大量存在,B错误;
C.在强碱性溶液中OH-与选项离子不能发生任何反应,可以大量共存,C正确;
D.在强碱性溶液中OH-与HCO3-会发生离子反应,产生CO32-、H2O,不能大量存在,D错误;故合理选项是C。

【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件. 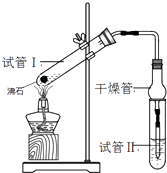
物质 | 沸点/°C | 密度/gcm﹣3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:(按着加入的先后顺序写出名称),乙醇过量的目的是:;
(2)该反应的平衡常数表达式K=;
(3)试管Ⅱ中所盛试剂为 , 欲将其物质分离使用的仪器为 , 在充分振荡的过程中,发生的反应为;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和mol/L;
②分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会(“较高”或“偏低”).