题目内容
下列说法正确的是( )
| A.第一电离能越小的元素其单质金属活泼性一定越大 |
| B.电负性越小的元素金属性一定越强 |
| C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键 |
| D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 |
D
解析试题分析:金属单质的活泼性还与单质的结构有关,A、B错误;元素电负性相差小于1.7的元素,如果是多原子也可能形成离子键,如氯化铵等铵盐,C项错误;IA的第一电离能比较低,容易失电子,适合制造光电材料,D项正确。
考点:本题考查第一电离能、电负性与金属性的关系。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
下列各项内容中,排列顺序正确的是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
五种短周期元素X、Y、Z、M、N的原子序数依次增大,X、Y、Z、M是组成蛋白质的基础元素,M原子的最外层电子数是电子层数的3倍,N2M2可用于潜水艇中作为氧气的来源,下列说法错误的是
| A.与Y同主族的短周期元素可与强碱反应生成氢气 |
| B.X和M形成的化合物分子中可能含有非极性共价键 |
| C.由X、Z、M形成的化合物一定是共价化合物 |
| D.等物质的量的N2YM3粉末和NXYM3粉末分别与等浓度的盐酸反应,后者反应速率要快 |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表。下列说法正确的是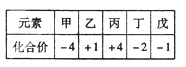
| A.乙的单质中能与水剧烈反应 |
| B.气态氢化物的稳定性:丙>甲 |
| C.丙的氧化物能与戊的氢化物水溶液反应 |
| D.其最高价氧化物对应的水化物的酸性:丁>戊 |
M、N为短周期的两种元素,M元素原于的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其有关说法正确的是
| A.M、N可能为金属 |
| B.若M、N为同周期元素,则原于半径M<N |
| C.M、N元素的单质可能与水发生置换反应 |
| D.M、N形成的离子化合物不能体现强氧化性 |
依据元素周期表及元素周期律,下列推断正确的是
| A.HCl、HBr、HI的热稳定性依次增强 |
| B.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| C.同主族元素从上到下,单质的熔点逐渐降低 |
| D.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
现有下列短周期元素性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
下列说法正确的是
A.原子序数④元素大于⑦元素
B.②.③处于同一周期
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为:
