题目内容
M、N为短周期的两种元素,M元素原于的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其有关说法正确的是
| A.M、N可能为金属 |
| B.若M、N为同周期元素,则原于半径M<N |
| C.M、N元素的单质可能与水发生置换反应 |
| D.M、N形成的离子化合物不能体现强氧化性 |
C
解析试题分析:A、短周期元素中最外层电子数大于4个只能是非金属,A不正确;B、同周期自左向右原子半径逐渐减小,M元素原于的最外层电子数≤4,N元素原子的最外层电子数>4,所以原子半径是M大于N,B不正确;C、M可能是碱金属,N可能是F,因此均能和水发生置换反应,C正确;D、二者形成的化合物有可能是过氧化钠,过氧化钠具有强氧化性,D不正确,答案选C。
考点:考查元素周期表的结构和元素周期律的应用

练习册系列答案
相关题目
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
| A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+) |
| B.元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
下列叙述正确的是
| A.同种元素的原子均具有相同的质子数和中子数 |
| B.不同元素的原子构成的分子只含极性键 |
| C.第三周期中的非金属元素的气态氢化物还原越强,对应元素的最高价含氧酸酸性越弱 |
| D.第ⅦA族元素从上到下单质及对应的气态氢化物的沸点均逐渐升高。 |
下列说法正确的是( )
| A.第一电离能越小的元素其单质金属活泼性一定越大 |
| B.电负性越小的元素金属性一定越强 |
| C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键 |
| D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 |
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
| A.化合物XZW既含离子键也含共价键 |
| B.对应气态氢化物的稳定性Y>Z |
| C.对应简单离子半径:X>W |
| D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
元素的原子结构决定其性质和在周期表中的位置。下列叙述正确的是
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |
据报道,每百吨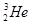 核聚变所释放出的能量相当于目前人类一年消耗的能量,在地球上氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量,在地球上氦元素主要以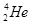 的形式存在。有关该元素说法正确的是
的形式存在。有关该元素说法正确的是
A.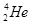 原子核内有4个质子 原子核内有4个质子 |
B.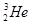 和 和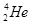 互为同位素 互为同位素 |
C.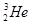 原子核内有3个中子 原子核内有3个中子 |
D.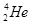 最外层只有2个电子故具有较强的金属性 最外层只有2个电子故具有较强的金属性 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是
| A.简单离子半径大小顺序:rT>rX>rY |
| B.T与Z的最高正化合价相等 |
| C.室温下,单质Y不能与浓硫酸反应 |
| D.用电解法可制得T、X、Y的单质 |