题目内容
6.香花石(Hsianghualite)是中国地质学家发现的第一种世界新矿物,由元素周期表前20号主族元素中的6种组成,其化学式可表示为X3Y2(ZWR4)3T2.其中,X、Y、Z为金属元素,X、Z为同主族元素,Y、Z、R、T为同周期元素,T为非金属性最强的元素;Z原子的最外层电子数与次外层电子数相等,R原子的最外层电子数为次外层电子数的3倍,X与R的原子序数之和是W的2倍.下列判断不正确的是( )| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应水化物的碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
分析 T为非金属性最强的元素,则T为F元素;Y、Z、R、T为同周期元素,即处于第二周期,Z原子的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;R原子的最外层电子数为次外层电子数的3倍,R为O元素;X、Z为同主族元素,则X为Mg元素或Ca元素,若X为Mg元素,则由X与R原子序数之和是W的2倍,W原子序数为$\frac{12+8}{2}$=10,为氖元素,不符合题意,若X为Ca元素,W原子序数为$\frac{20+8}{2}$=14,符合题意,即X为Ca元素、W为Si.
解答 解:T为非金属性最强的元素,则T为F元素;Y、Z、R、T为同周期元素,即处于第二周期,Z原子的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;R原子的最外层电子数为次外层电子数的3倍,R为O元素;X、Z为同主族元素,则X为Mg元素或Ca元素,若X为Mg元素,则由X与R原子序数之和是W的2倍,W原子序数为$\frac{12+8}{2}$=10,为氖元素,不符合题意,若X为Ca元素,W原子序数为$\frac{20+8}{2}$=14,符合题意,即X为Ca元素、W为Si.
A.同周期从左到右原子半径减小,故原子半径:Li>Be>O>F,故A正确;
B.XR2、WR2两化合物CaO2、SiO2,前者氧元素化合价为-1,后者氧元素化合价为-2,故B错误;
C.元素的金属性越强,对应的最高价氧化物的碱性越强,金属性Ca>Be,故最高价氧化物对应水化物的碱性:Ca(OH)2>Be(OH)2,故C正确;
D.元素的非金属性越强,对应的氢化物越稳定,非金属性:Si<O<F,故气态氢化物的稳定性:SiH4<H2O<HF,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周期律的考查,难度中等.

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案| A. | 用铁片与硫酸反应制取氢气时,用98%的硫酸可以加快产生氢气的速率 | |
| B. | 向氯水中加入少量的AgNO3溶液,可使氯气与水反应的平衡向逆反应方向移动 | |
| C. | 洁净的酸(或碱)式滴定管在加入酸(或碱)溶液之前,要用所要盛装的酸(或碱)溶液润洗2-3次 | |
| D. | 常温下,向饱和硫酸钙溶液中加入碳酸钠溶液一定会有沉淀生成 |
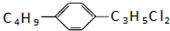 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 24种 | B. | 36种 | C. | 48种 | D. | 60种 |
| A. | F-的结构示意图: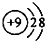 | B. | 乙烯分子比例模型: | ||
| C. | 乙酸的结构式:C2H4O2 | D. | Na2O的电子式: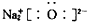 |
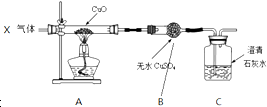
| A. | 若A中固体变红,B中固体变蓝,C中无明显现象,则X气体中含有H2 | |
| B. | 若A中固体变红,B中无明显现象,C中石灰水变浑浊,则X气体中含有CO | |
| C. | 若A中固体变红,B中固体变蓝,C中石灰水变浑浊,则X气体一定有CO | |
| D. | 若A中固体变红,B中固体变蓝,C中石灰水变浑浊,则X气体可能是CO、CO2和H2 |
| A. | 碳酸钠溶液 | B. | 湿润的蓝色石蕊试纸 | ||
| C. | 湿润的淀粉碘化钾试纸 | D. | 硝酸银溶液 |
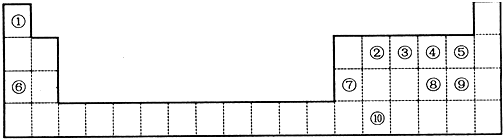
 ,元素②形成的最高价氧化物的结构式为O=C=O;
,元素②形成的最高价氧化物的结构式为O=C=O; 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题: