题目内容
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是电子层数的3倍,C+和D3+离子的电子层结构相同,B与E属于同一主族.请回答下列问题:
(1)E在元素周期表中的位置是________
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号).
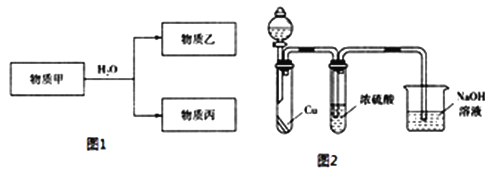
(3)由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为________.
②若丙的水溶液是强碱性溶液,则甲为______________(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为________;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因________.
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入________(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是________.
【答案】 第三周期第VIA族 Al3+ ![]() Na或Na2O2 硫化氢或氢硫酸 AlO2﹣+H2O+H+Al(OH)3Al3++3OH﹣ 浓硝酸 ;浓硫酸不能干燥二氧化氮或二氧化氮能溶于浓硫酸
Na或Na2O2 硫化氢或氢硫酸 AlO2﹣+H2O+H+Al(OH)3Al3++3OH﹣ 浓硝酸 ;浓硫酸不能干燥二氧化氮或二氧化氮能溶于浓硫酸
【解析】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的气态氢化物能与其最高价氧化物的水化物反应,则A是N元素;B原子最外层电子数是电子层数的3倍,B为O元素;B与E属于同一主族,则E是S元素;F为短周期主族元素且原子序数大于E,则F为Cl元素;![]() 和
和![]() 离子的电子层结构相同,为第三周期元素,C、D分别为Na、Al元素。
离子的电子层结构相同,为第三周期元素,C、D分别为Na、Al元素。
(1)E是S元素,S原子核外电子层数等于其周期数、最外层电子数等于其族序数,S原子核外有3个电子层、最外层电子数是6,所以S位于第三周期第VIA族;正确答案:第三周期第VIA族。
(2)上述元素形成的简单离子中,电子层数越少的原子半径越小,电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种元素形成的离子半径大小顺序是![]() P,所以离子半径最小的是
P,所以离子半径最小的是![]() ,正确答案:
,正确答案:![]() 。
。
(3)①若乙具有漂白性,为HClO,则甲是氯气、丙是HCl,HClO分子中O原子和H、Cl原子之间分别共用一对电子,电子式为:![]() ;正确答案:
;正确答案:![]() 。
。
②若丙的水溶液是强碱性溶液,则甲为Na或![]() ,丙为NaOH,乙为氢气或氧气,正确答案:Na或
,丙为NaOH,乙为氢气或氧气,正确答案:Na或![]() 。
。
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,丙为氢氧化铝;乙为硫化氢,则甲是硫化铝,乙名称为硫化氢或氢硫酸,氢氧化铝能发生酸式电离也能发生碱式电离,电离方程式为AlO2﹣+H2O+H+Al(OH)3Al3++3OH﹣,所以氢氧化铝能溶于强碱和强酸溶液;正确答案:硫化氢或氢硫酸; AlO2﹣+H2O+H+Al(OH)3Al3++3OH﹣。
④用如图2装置进行实验时,浓硝酸和Cu反应生成二氧化氮,所以分液漏斗中液体是浓硝酸;实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,则二氧化氮溶于浓硫酸,说明二氧化氮能溶于浓硫酸或浓硫酸不能干燥二氧化氮;正确答案:浓硝酸;浓硫酸不能干燥二氧化氮或二氧化氮能溶于浓硫酸。