题目内容
16.将0.2mol•L-1的H2S溶液与0.2mol•L-1的NaOH溶液等体积混合后,所的溶液中各离子浓度大小关系正确的是( )| A. | c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(OH-) | ||
| C. | c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) | D. | c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+) |
分析 等物质的量浓度、等体积的硫化氢和NaOH恰好完全反应生成NaHS,HS-水解程度大于其电离程度导致溶液呈碱性,但其水解程度和电离程度都较小;水的电离和HS-水解都生成OH-,HS-和水都电离生成H+,只有HS-电离生成S2-,据此判断离子浓度大小,
解答 解:等物质的量浓度、等体积的硫化氢和NaOH恰好完全反应生成NaHS,HS-水解程度大于其电离程度导致溶液呈碱性,则c(OH-)>c(H+);但其水解程度和电离程度都较小,钠离子不水解,则c(Na+)>c(HS-);水的电离和HS-水解都生成OH-,HS-和水都电离生成H+,只有HS-电离生成S2-,所以c(H+)>c(S2-),则离子浓度大小顺序是c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故选C.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,易错点是判断c(H+)、c(S2-)相对大小,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测定稀酸的pH,测定值偏大 | |
| B. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 | |
| C. | 中和滴定前滴定管尖嘴处有气泡,终点读数时无气泡,所测溶液体积偏大 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
4.下列反应的离子方程式书写正确的是( )
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的氢氧化钠溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
11.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生反应的化学方程式为:5KClO3+6P═3P2O5+5KCl,则下列有关叙述错误的是( )
| A. | 上述反应是放热反应 | |
| B. | 该反应氧化剂与还原剂物质的量之比为6:5 | |
| C. | 产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) | |
| D. | 上述反应中消耗3molP时,转移电子的物质的量为15mol |
8.下列化学反应对应的离子方程式书写正确的是( )
| A. | FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O |
5.工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
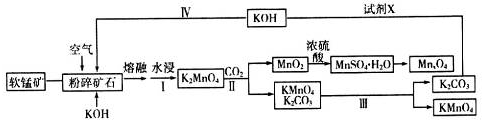
请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
(4)上述工业流程中试剂X的最佳物质是(填化学式)Ca(OH)2(或CaO);设计步骤Ⅳ的目的是循环利用二氧化锰、氢氧化钾,提高原料利用率.
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.


请回答下列问题:
(1)K2MnO4中锰元素的化合价是+6.
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(3)分析下表数据.工业上采用Ⅲ得到较纯净的高锰酸钾,Ⅲ中包含的操作名称是蒸发结晶、过滤、洗涤、干燥.
| 温度/℃ 溶解度/g | 10 | 20 | 30 | 40 | 60 |
| KC2O3 | 107 | 109 | 111 | 114 | 126 |
| KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 |
(5)通过煅烧MnSO4•H2O可制得软磁铁氧体材料MnxO4.下图是煅烧MnSO4•H2O时温度与剩余固体质量变化的曲线.该曲线中A段所表示物质的化学式是MnSO4;MnxO4中x=3.
