题目内容
【题目】(化学——选修3:物质结构与性质)
镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为______,价层电子排布式为________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4 的熔、沸点较低的原因为________。
②写出一种与CO 互为等电子体的分子的化学式________。
③Ni(CO)4中 σ 键和 π 键的数目之比为________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为________,该离子中杂化轨道的作用是________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
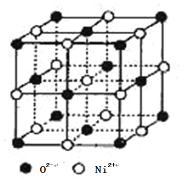
①镍离子的配位数为________。
②天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为Ni0.97O(相对分子质量为73), 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为________;若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为________pm(列出表达式)。
【答案】3d3d84s2Ni(CO)4 属于分子晶体, 分子间的范德华力容易被破坏N21:1sp3形成 σ 键691:6 或 6:91![]()
【解析】
(1)镍的原子序数为28,其电子排布式为1S22S22P63S23P63d84s2,其价电子的轨道表达式为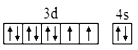 ,所以基态镍原子核外电子填充的能量最高的能级符号为3d,价层电子排布式为3d84s2;
,所以基态镍原子核外电子填充的能量最高的能级符号为3d,价层电子排布式为3d84s2;
因此,本题正确答案为:3d ;3d84s2;
(2) ①由于Ni(CO)4属于分子晶体,分子间的范德华力容易被破坏,因此Ni(CO)4 的熔、沸点较低;
②原子数与价电子数都相等的互为等电子体,CO含有2个原子14个电子,则与CO 互为等电子体的分子为N2;
③单键都是σ 键,三键分子中有1个σ 键和2个π 键,所以分子中σ键和π键的数目之比为8:8=1:1;
因此,本题正确答案为:Ni(CO)4 属于分子晶体, 分子间的范德华力容易被破坏;N2;1:1;
(3) SO42-中S原子价电子对数是4,不含孤对电子,因此SO42-的中心原子的杂化轨道类型为sp3,该离子中杂化轨道可用于形成 σ 键,
因此,本题正确答案为:sp3;形成 σ 键;
(4)①根据氯化钠的晶胞可知镍离子的配位数为6;
②设+2和+3价两种Ni的原子数分别是x、y,则依据原子守恒和电荷守恒有:x+y=0.97,2x+3y=2![]() 1,解得x:y=0.91:0.06=91:6;
1,解得x:y=0.91:0.06=91:6;
根据氯化钠晶胞结构可知:每个晶胞含有4个O2-,则1mol晶胞中有4mol Ni0.97O,其质量为 4(59![]() 0.97g+16g)=292.92g。晶胞中O2-之间的最近距离为面对角线的一半。若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,设晶胞的边长为a,则
0.97g+16g)=292.92g。晶胞中O2-之间的最近距离为面对角线的一半。若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,设晶胞的边长为a,则![]() =
=![]() ,解得a=
,解得a=![]() cm,即该晶体的棱长为
cm,即该晶体的棱长为![]() cm,所以晶胞中最近的 O2-之间的距离为
cm,所以晶胞中最近的 O2-之间的距离为![]() pm,
pm,
因此,本题正确答案为:6 ;91:6 或 6:91; ![]() 。
。


