题目内容
【题目】在酸性介质中,往MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下反应:2Mn2+ + 5S2O82- + 8H20=2MnO4- + 10SO42- + 16H+。
(1)用单线桥表示上述方程式电子转移方向和数目:____________ 。
(2)该反应中还原剂为:____________________________。
(3)该反应常用于检验Mn2+的存在,其现象是:________________________________。
(4)若反应中有0.1mol的还原剂参加反应,则转移的电子数目为__________NA,消耗氧化剂的物质的量为____________mol。
【答案】 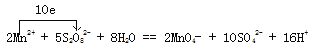 MnSO4 溶液变为紫红色 0.5 0.25
MnSO4 溶液变为紫红色 0.5 0.25
【解析】(1)反应中Mn元素化合价由+2价升高为+7价,Mn2+是还原剂,S元素化合价由+7价降低为+6价,S2O82-是氧化剂,据此配平离子反应方程式;
(2)失去电子的物质是还原剂;
(3)反应生成MnO4-,溶液变成紫红色;
(4)根据电子转移守恒计算消耗S2O82-的物质的量。
(1)反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,失去5个电子,Mn2+是还原剂,S元素化合价由S2O82-中+7价降低为SO42-中+6价,得到1个电子,故根据电子得失守恒、原子守恒以及电荷守恒可知配平后的离子反应方程式为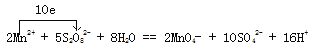 ;
;
(2)根据以上分析可知该反应中还原剂为MnSO4;
(3)反应中生成MnO4-,因此实验现象为溶液变成紫红色;
(4)反应中有0.1mol还原剂参加反应,即有0.1molMn2+参加反应,则转移电子数为0.5mol。S2O82-是氧化剂,根据电子转移守恒可知,消耗S2O82-的物质的量为0.5mol÷2=0.25mol。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】下列说法不正确的是( )
A.浓硫酸有氧化性,稀硫酸没有氧化性
B.可以用无锈铁丝代替铂丝进行焰色反应
C.氯水应保存在棕色细口试剂瓶中
D.硫酸铜溶液和氢氧化铁胶体都属于分散系,后者能产生丁达尔效应
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |