题目内容
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。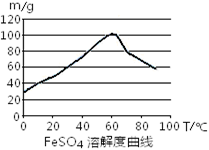
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为 。若要提高FeSO4生成速率,采取下列措施中正确的是 。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是 。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行 、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: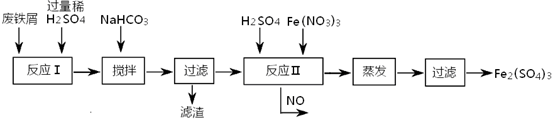
①加入NaHCO3并搅拌,将混合液pH调控至 范围内,使杂质沉淀过滤除去。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
②反应Ⅱ中反应的离子方程式是: 。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是 ,气体X与NO配比的比例是 。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是 。
(1)① Fe+2H+=Fe2++H2↑ B、C ② A、C ③ 过滤 (2)① 6.7~7.5
② 3Fe2++NO3-+4H+ =3Fe3++NO↑+2H2O ③ 节约Fe(NO3)3、防止NO污染 3 : 4
(3)2Fe3++3S2- ="2" FeS↓+S
解析试题分析:(1)铁和氢离子发生置换反应制备硫酸亚铁,可以使用铁粉增大接触面积,加快速率,B正确;但是不能用浓硫酸,铁在常温条件下遇浓硫酸钝化,A错误;硫酸亚铁在60℃时溶解度高,所以选择温度在50~70℃,C正确,D错误。减少Fe2+被氧化,控制硫酸浓度,减少H+浓度,平衡逆向移动,A正确,B、稀释浓硫酸应该把硫酸向水中加,并不断搅拌,错误;C、铁过量可以防止Fe2+被氧化,正确;D、加入Fe3+将会增加Fe3+浓度,错误。反应结束后,过滤除去过量的铁,再降低温度,硫酸亚铁的溶解度减小,析出晶体。(2)废铁屑加入过量的稀硫酸,铁和铝溶解,铜不溶,再加NaHCO3调PH至6.7~7.5之间,Al3+、Cu2+沉淀,再过滤,加入氧化剂把Fe2+氧化,蒸发结晶得产物。为了节约Fe(NO3)3、防止NO污染,可以利用氧气和NO按照3:4反应生成硝酸做氧化剂。
考点:考查物质的制备、元素化合物性质、基本实验操作、离子方程式的书写

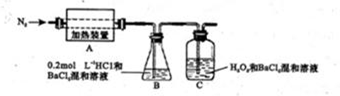
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、 、 、 。
(2)写出在A中加H2O2的离子方程式: 。
(3)向A中可以加入 (写化学式)调节溶液pH范围在 之间;沉淀C为 。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为 。
大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。 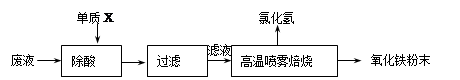
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol?L-1H2SO4、0.01 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中,_________________ ____________________________________________ | ___________________________ |
| 步骤2. ____________________________________________ | ___________________________ |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。