题目内容
将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下容器中金属离子与金属单质的存在情况:
(1)若Fe粉有剩余,则容器中不可能有____________
(2)若FeCl3有剩余,则容器中不可能有___________
(3)若CuCl2有剩余,则容器中还可能有________________________
(4)若FeCl3和CuCl2都有剩余,则容器中还可能有______________
(4分) (1)Fe3+和Cu2+ (2)Fe和Cu (3)Fe2+、Fe3+或Cu、Fe2+ (4)Fe2+
解析试题分析:(1)由于氯化铁、氯化铜都能氧化单质铁,所以若Fe粉有剩余,则容器中不可能有Fe3+和Cu2+。
(2)由于氯化铜既能氧化单质铁,也能氧化单质铜,所以若FeCl3有剩余,则容器中不可能有Fe和Cu。
(3)由于氯化铜只能氧化单质铁,所以若CuCl2有剩余,则容器中还可能有Fe2+、Fe3+或Cu、Fe2+。
(4)由于氯化铁、氯化铜都能氧化单质铁,而氯化铁还能氧化单质铜,所以若FeCl3和CuCl2都有剩余,则容器中还可能有Fe2+。
考点:考查氧化还原反应的有关应用

 阅读快车系列答案
阅读快车系列答案(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
| A.H2O2溶液 | B.铜粉 | C.稀硫酸 | D.KMnO4溶液 |
 4Fe(OH)3+8OH—+3O2
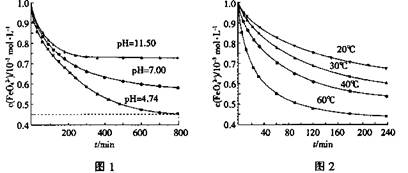
4Fe(OH)3+8OH—+3O2①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况。pH =4.74时,反应从开始到800min的平均反应速率v(FeO42—)=______ (保留两位有效数字)。
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变。观察图1判断随着pH 变大,此反应的平衡常数______(填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H______0(填“>”、“<”、“=”)。
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。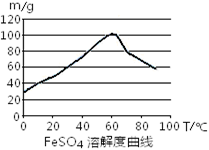
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为 。若要提高FeSO4生成速率,采取下列措施中正确的是 。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是 。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行 、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: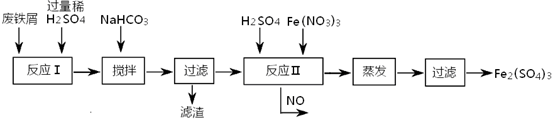
①加入NaHCO3并搅拌,将混合液pH调控至 范围内,使杂质沉淀过滤除去。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
②反应Ⅱ中反应的离子方程式是: 。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是 ,气体X与NO配比的比例是 。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是 。
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。
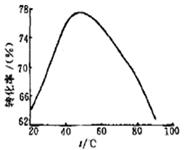
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12Ca(OH)2(s)
 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份:①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。下列说法正确的是
| A.V1=V3>V2 | B.V2>V1 =V3 | C.V1= V2>V3 | D.V1>V3>V2 |
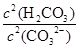 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)