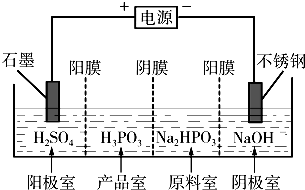
题目内容
常温下,有关下列4种溶液的说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | Ph=11 氨水 | 0.1mol?L-1 盐酸 | pH=3 盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
| C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>C(Cl-) |
| D.②与④等体积混合,混合液pH>7 |
A.酸和碱抑制水的电离,氢离子或氢氧根的浓度越大,水的电离程度越小;0.1mol?L-1氨水电离出来的氢氧根的浓度小于0.1mol?L-1盐酸电离的氢离子浓度,所以对水的电离抑制程度小,则由水电离出的c(H+):①>③,故A错误;
B.一水合氨是弱电解质,在溶液中部分电离,0.1mol?L-1氨水中PH<13,所以①稀释到原来的100倍,pH与②不相同,故B错误;
C.①与③混合,若溶液pH=7,由溶液中电荷守恒可知:c(NH4+)+c(H+)=C(Cl-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=C(Cl-),故C错误;
D.一水合氨是弱电解质,在溶液中一水合氨的浓度大于氢氧根离子的浓度,所以Ph=11氨水的浓度大于10-3mol?L-1,因此②与④等体积混合时,氨水过量,溶液显碱性,混合液pH>7,故D正确.
故选D.
B.一水合氨是弱电解质,在溶液中部分电离,0.1mol?L-1氨水中PH<13,所以①稀释到原来的100倍,pH与②不相同,故B错误;
C.①与③混合,若溶液pH=7,由溶液中电荷守恒可知:c(NH4+)+c(H+)=C(Cl-)+c(OH-),因为c(H+)=c(OH-),所以c(NH4+)=C(Cl-),故C错误;
D.一水合氨是弱电解质,在溶液中一水合氨的浓度大于氢氧根离子的浓度,所以Ph=11氨水的浓度大于10-3mol?L-1,因此②与④等体积混合时,氨水过量,溶液显碱性,混合液pH>7,故D正确.
故选D.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目