题目内容
【题目】下列说法错误的是

A. X→Y反应类型为酯化反应
B. X、Y、Z均能使溴的四氯化碳溶液褪色
C. Y和Z互为同分异构体
D. 等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:1
【答案】C
【解析】A. 酸与醇反应生成酯的反应为酯化反应,X与CH3OH在浓硫酸的催化下生成了-COOCH3,是酯化反应。A正确;B. 三种物质的结构式中,均含有C=C,能与溴发生加成反应,使溴的四氯化碳溶液褪色,B正确;C. Y、Z的结构式中分别含有氧原子的个数为3、4,两者不是同分异构体,故C错误;D. Na在反应中取代-OH中的H,1molX物质中含有2mol-OH,1molZ中含有-0H为1mol,故相同物质的量X、Z与足量Na反应,消耗Na的物质的量之 比为2:1,D正确。故选择C。

【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取M4.5 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为: __ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____ 。 |
(3)通过M 的红外光谱图发现该分子中既有 羟基,还有羧基 | (3)写出M中含有的官能团羟基电子式:__ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有___种氢原子。 |
(5)综上所述,M 的结构简式为_____ 。 | |
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=________________KJ/mol。
(2)1L 1mol/LH2SO4溶液与2L 1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式_________________________________________________。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:______________________________________________(用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 _____________(填“酸式”或“碱式”)滴定管中。润洗滴定管的操作方法是_____________________________________________________。
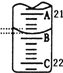
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为________mL。
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是由以下选项中的______________引起。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C =_______________ mol/L。




