题目内容
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=________________KJ/mol。
(2)1L 1mol/LH2SO4溶液与2L 1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式_________________________________________________。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:______________________________________________(用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 _____________(填“酸式”或“碱式”)滴定管中。润洗滴定管的操作方法是_____________________________________________________。
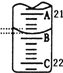
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为________mL。
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是由以下选项中的______________引起。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C =_______________ mol/L。
【答案】 -20.9(T2—T1) 1/2 H2SO4(aq) + NaOH(aq)=1/2 Na2SO4(aq) + H2O(l) △H=-57.3 kJ/mol 6H++2MnO4﹣+5H2C2O4═2Mn2++10CO2↑+8H2O 酸式 向滴定管内注入少量标准液,倾斜转动滴定管润洗全部内壁后,从尖嘴放出液体;重复上述操作2-3次即可 21.40 CD C=60C/V
【解析】Ⅰ.(1)根据Q=mc△T=4.18J/(g℃)×100mL×1g/cm3(T2-T1)=0.418(T2-T1)kJ,中和热的计算式△H=-![]() =-
=-![]() =-20.9(T2—T1)kJ/mol;(2)1L 1mol/LH2SO4溶液与2L 1mol/LNaOH溶液完全反应,放出114.6 kJ的热量,则生成1mol水放出57.3kJ的热量,
=-20.9(T2—T1)kJ/mol;(2)1L 1mol/LH2SO4溶液与2L 1mol/LNaOH溶液完全反应,放出114.6 kJ的热量,则生成1mol水放出57.3kJ的热量,
反应的热化学方程式为: ![]() H2SO4(aq) + NaOH(aq)=
H2SO4(aq) + NaOH(aq)=![]() Na2SO4(aq) + H2O(l) △H=-57.3 kJ/mol;
Na2SO4(aq) + H2O(l) △H=-57.3 kJ/mol;
Ⅱ.(1)MnO4-(H+)→Mn2+、H2C2O4→CO2 反应中其他元素没有得、失电子,据Mn和C的化合价变化分析,MnO4-与H2C2O4的物质的量之比为2:5,再据原子守恒和电荷守恒得到的离子方程式为:6H++2MnO4-+5H2C2O4=2Mn2++10CO2↑+8H2O;滴定原理为:6H++2MnO4﹣+5H2C2O4═2Mn2++10CO2↑+8H2O;(2)高锰酸钾具有很强的氧化性,应用酸式滴定管盛装;润洗滴定管的操作方法是: 向滴定管内注入少量标准液,倾斜转动滴定管润洗全部内壁后,从尖嘴放出液体;重复上述操作2-3次即可;(3)如图表示50mL滴定管中液面的位置, A与C刻度间相差1 mL,A处的刻度为21,滴定管中液面读数应为21.40mL;(4)A、俯视反而使得读数偏小,消耗的体积也变小,选项A不符合;B、滴加KMnO4溶液要点滴,尤其到滴定终点时更要慢,而且溶液变色要半分钟不褪色,否则体积偏小,选项B不符合;C、未用标准液润洗,滴定管中残留的水会稀释标准液,使得浓度变小,滴定消耗的体积变大,选项C符合;D、滴定用的锥形瓶用待装液润洗过,会使得锥形瓶中待装液浓度变大,从而消耗标准液的量增大,选项D符合。答案选CD;(5)根据离子反应方程式6H++2MnO4﹣+5H2C2O4═2Mn2++10CO2↑+8H2O可知,高锰酸钾和草酸反应的物质的量之比为2:5,消耗高锰酸钾物质的量为![]() ×10-3L/mL×cmol/L=0.012cmol,则VmL草酸的浓度为:
×10-3L/mL×cmol/L=0.012cmol,则VmL草酸的浓度为: ![]() =
=![]() mol/L。
mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。