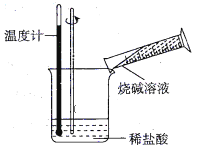
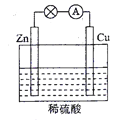
题目内容
【题目】利用碳酸钠晶体(Na2CO3·10H2O)来配制1.0 mol·L-1Na2CO3溶液500 mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
A. 称取碳酸钠晶体53.0 g
B. 定容时,俯视观察刻度线
C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D. 定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
【答案】B
【解析】
根据![]() 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。
A、1.0 mol/L的碳酸钠溶液500 mL需称取Na2CO3·10H2O的质量是1.0mol/L×0.5L×286g/mol=143g,称取碳酸钠晶体53.0 g会导致浓度偏低,A错误;
B、定容时俯视刻度线,会造成所配溶液的体积偏小,浓度偏高,B正确;
C、未冲洗溶解碳酸钠晶体的烧杯,会造成碳酸钠损失,浓度偏低,C错误;
D、定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线,溶液体积增加,会造成所配溶液的浓度偏低,D错误。
答案选B。

练习册系列答案
相关题目