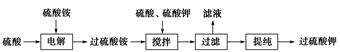
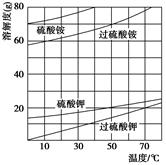
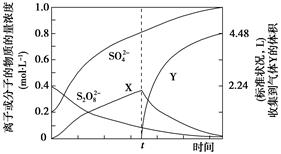
题目内容
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。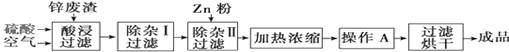
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是 。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。
为控制上述PH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是 。“操作A”的名称是 。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 。
(1)烧杯、玻璃棒、漏斗(3分);
(2)将Fe2+完全氧化为Fe3+,便于完全沉淀(2分);5.2~5.4(2分);AD(2分)
(3)除去溶液中的Cu2+(1分);冷却结晶(1分)
(4)5(2分)
解析试题分析:(1)过滤操作中需要的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)溶液中的铁、铝元素最终以沉淀形式除去,所以加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+,便于完全沉淀;根据表中数据pH=5.2时Al(OH)3完全沉淀,Fe(OH)3也已沉淀完全,但Zn(OH)2不能沉淀,所以溶液的pH范围为5.2~5.4;加入的试剂或药品既能中和酸调节pH值,同时不能引入新的杂质,所以只能选择AD;
(3)溶液中的铁、铝元素除去后仍存在铜离子,所以加入Zn粉目的是除去铜离子;加热浓缩后的步骤是冷却结晶;
(4)Ksp〔Cu(OH)2〕=2×10-20,溶液中c(Cu2+)=0.02 mol·L-1,所以只需c(Cu2+)×c(OH-)2>=2×10-20, Cu(OH)2沉淀即可生成,解得c(OH-)>=1×10-9,所以pH>=5.
考点:考查仪器的选择,溶液的除杂,对实验步骤的分析判断,溶液pH的计算

已知甲、乙的某些性质如下:
| 物质 | 密度/(g·mL-1) | 沸点 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 能溶于水且溶于乙 |
| 乙 | 1.220 | 100.7℃ | 能溶于水且溶于甲 |
A.蒸馏 B.干馏 C.分液 D.过滤
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、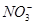 、
、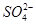 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论) 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2

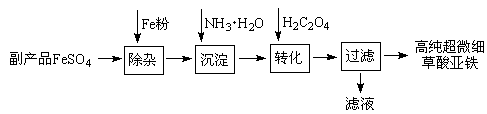



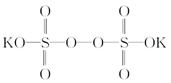 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: