题目内容
【题目】25℃时,用浓度为0.100 0 mol·L1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
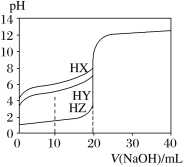
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线可得Ka(HX)的数量级是107
C.HX、HY与HZ溶液中均存在两种平衡
D.HY与HZ混合,达到平衡时c(H+)=![]() +c(Z)+c(OH)
+c(Z)+c(OH)
【答案】B
【解析】
A项、在相同温度下,溶液中离子浓度越大,溶液的导电性越强,由图像起点可知,三种酸溶液的酸性大小顺序为HZ>HY>HX,在相同温度下,同浓度的三种酸溶液中离子浓度得大小顺序为HZ>HY>HX,则三种酸溶液的导电能力顺序为HZ>HY>HX,故A错误;
B项、由图像起点可知,0.100 0 mol·L1 HX溶液的pH为4,溶液中c(H+)=c(X)=10—4mol/L,c(HX)= 0.100 0 mol/L—10—4mol/L≈0.100 0 mol/L,则Ka(HX)=![]() =
=![]() = 107,故B正确;
= 107,故B正确;
C项、由图像起点可知,0.100 0 mol·L1 HZ溶液的pH为1,说明HZ为强酸,在溶液中完全电离,只存在水的电离平衡,故C错误;
D项、由Ka(HY)=![]() 可知
可知![]() = c(H+),若HY与HZ混合,达到平衡时c(H+)=
= c(H+),若HY与HZ混合,达到平衡时c(H+)=![]() +c(Z)+c(OH)成立,得到c(Z)+c(OH)=0,与HZ为强酸溶液中一定存在Z不相符,故D错误;
+c(Z)+c(OH)成立,得到c(Z)+c(OH)=0,与HZ为强酸溶液中一定存在Z不相符,故D错误;
故选B。

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
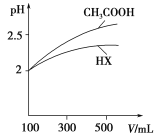
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。

