题目内容
1.a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )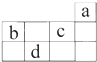
| A. | a原子的最外电子层上有8个电子 | |
| B. | c的最高价氧化物对应水化物为强酸 | |
| C. | d的原子半径比c的原子半径大 | |
| D. | b的气态氢化物比c的气态氢化物稳定 |
分析 根据元素在周期表中的位置知,a、b、c、d分别是He、N、F、S元素,
A.He原子最外层电子数是2;
B.C是F元素,F是非金属性最强的元素,没有正化合价;
C.电子层数越多的原子,其原子半径越大;
D.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其气态氢化物越稳定.
解答 解:根据元素在周期表中的位置知,a、b、c、d分别是He、N、F、S元素,
A.当第一电子层为最外层时,最多排列2个电子,He原子最外层电子数是2,故A错误;
B.c是F元素,F是非金属性最强的元素,没有正化合价,所以没有最高价氧化物的水化物,故B错误;
C.电子层数越多的原子,其原子半径越大,S原子有3个电子层,F原子有2个电子层,所以S原子半径大于F原子,故C正确;
D.同一周期元素中,元素的非金属性随着原子序数的增大而增强,F的原子序数大于N,所以F元素的非金属性大于N,故HF稳定性大于氨气,故D错误;
故选C.
点评 本题考查了元素位置结构性质的相互关系及应用,根据元素在周期表中的位置进行判断元素,再结合元素周期律来分析解答,注意F元素没有含氧酸,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列文字表述与反应方程式对应且正确的是( )
| A. | 甲烷与氯气反应:CH4+4Cl2→CCl4+4HCl | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 乙醇和钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| D. | 苯和浓硝酸、浓硫酸的混合物水浴60℃反应: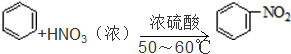 |
9.元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是( )
| A. | B2A3 | B. | B2A | C. | BA2 | D. | BA |
16.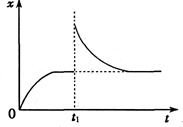 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )| A. | v逆 | B. | c(CO2) | C. | △H | D. | ρ(容器内气体密度) |
6.下列说法中,正确的是( )
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
10. 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
11.下列说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
 .
.