题目内容
【题目】下图两个实验装置是实现化学能和电能相互转化的装置。
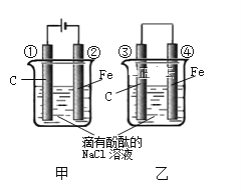
(1)把电能转化为化学能的装置是________(填“甲”或“乙”)
(2)铁电极腐蚀更严重的装置是_______(填“甲”或“乙”)
(3)②电极上的电极反应式为______________ ③电极上的电极反应式为________
(4)甲、乙两装置电极附近的溶液首先变红的电极是 ______
a.①② b②③ c③④ d①④
(5)写出装置甲反应的离子方程式 ________
【答案】甲 乙 2H++2e-=H2 ↑ O2+2H2O+4e-=4OH- B 2 Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
【解析】
根据原电池及电解池的原理及装置特点分析判断;根据吸氧腐蚀原理分析书写电极反应式;根据电解池原理及反应物书写装置中的电解方程式。
(1)甲装置中有直流电源,属于电解池,能将电能转化为化学能;没有外接电源且能自发进行氧化还原反应的装置为原电池,原电池将化学能转化为电能,乙装置能自发进行氧化还原反应,符合原电池条件,所以乙属于原电池;故答案为:甲;
(2)甲装置中铁电极作为阴极,不易被腐蚀,乙装置中铁作为负极,发生氧化反应,所以腐蚀比较严重,故答案为:乙;
(3)②电极为电解池的阴极,得电子发生还原反应,电极反应为2H++2e-=H2 ↑;③电极为原电池的正极,氧气得电子发生还原反应,属于吸氧腐蚀,电极反应为O2+2H2O+4e-=4OH-,故答案为:2H++2e-=H2 ↑ ;O2+2H2O+4e-=4OH-;
(4)甲装置中,阴极上氢离子放电,同时电极附近生成氢氧根离子,乙装置中碳电极上氧气得电子和水反应生成氢氧根离子,酚酞试液遇碱变红色,所以甲、乙两装置电极附近的溶液首先变红的电极分别是②、③,故答案为:B;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电生成氢气,所以电池反应式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,离子方程式为:2Cl- + 2H2O
2NaOH+Cl2↑+H2↑,离子方程式为:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑,故答案为:2Cl- + 2H2O
2OH- + H2↑+ Cl2↑,故答案为:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑。
2OH- + H2↑+ Cl2↑。

【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是________(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能
(2)已知:
Ⅰ.H2(g)+![]() O2(g)=H2O(g) H1=-241.8kJmol-1
O2(g)=H2O(g) H1=-241.8kJmol-1
Ⅱ.H2(g)+![]() O2(g)=H2O(l) H2=-285.8kJmol-1
O2(g)=H2O(l) H2=-285.8kJmol-1
气态分子中的化学键 | 断开1 mol化学键所需的能量/kJ |
O-H | 465 |
O=O | 498 |
①氢气的燃烧热为________kJmol-1.
②断开1 mol H-H键需要吸收的能量为________kJ。
③36 g H2O(1)完全分解生成氧气和氧气,需要吸收________kJ的能量。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
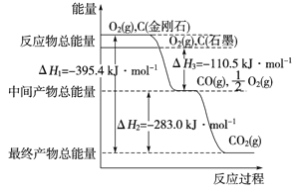
①在通常状况下,金刚石和石墨的稳定性较大的是________ (填“金刚石”或“石墨”)。
②12 g石墨在一定量空气中燃烧,生成36g气体,该过程放出的热量为________kJ。

