题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
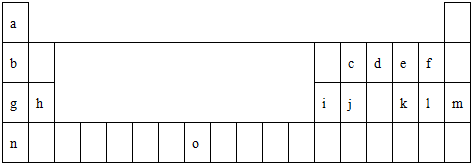
试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物的分子构型为 ,中心原子的杂化形式为 ;k在空气中燃烧产物
的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子.
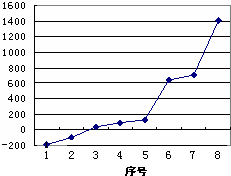
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表 (填元素符号)
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 ,试从结构角度加以解释: .

试回答下列问题:
(1)请写出元素o的基态原子电子排布式
(2)d的氢化物的分子构型为
的分子构型为
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表

(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
分析:(1)o为Fe,原子核外电子数为26,根据核外电子排布规律书写;
(2)d为N,其氢化物为NH3,计算N原子价层电子对数、孤对电子确定杂化方式与空间结构;
k为S,在空气中燃烧生成SO2,计算S原子价层电子对数、孤对电子确定杂化方式与空间结构,根据正负电荷重心是否重合判断分子极性问题;
(3)第三周期8种元素按单质熔点最高的为原子晶体Si;
(4)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,SiC晶体与晶体Si都是原子晶体,根据Si-C与Si-Si键能大小分析解答晶体熔点高低.
(2)d为N,其氢化物为NH3,计算N原子价层电子对数、孤对电子确定杂化方式与空间结构;
k为S,在空气中燃烧生成SO2,计算S原子价层电子对数、孤对电子确定杂化方式与空间结构,根据正负电荷重心是否重合判断分子极性问题;
(3)第三周期8种元素按单质熔点最高的为原子晶体Si;
(4)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,SiC晶体与晶体Si都是原子晶体,根据Si-C与Si-Si键能大小分析解答晶体熔点高低.
解答:解:(1)o为Fe,原子核外电子数为26,基态原子电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)d为N,其氢化物为NH3,N原子价层电子对数=3+
=4、含有1对孤对电子,故NH3为三角锥型,N原子产生sp3杂化;
k为S,在空气中燃烧生成SO2,S原子价层电子对数=2+
=3、含有1对孤对电子,SO2为V型结构,S原子采取sp2杂化,分子结构不对称,正负电荷重心不重合,为极性分子,
故答案为:三角锥型;sp3;V型;sp2;极性;
(3)序号“8”单质的熔点最高,第三周期8种元素单质熔点最高的为原子晶体Si,
故答案为:Si;
(4)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高,
故答案为:SiC;SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高.
故答案为:1s22s22p63s23p63d64s2;
(2)d为N,其氢化物为NH3,N原子价层电子对数=3+
| 5-1×3 |
| 2 |
k为S,在空气中燃烧生成SO2,S原子价层电子对数=2+
| 6-2×2 |
| 2 |
故答案为:三角锥型;sp3;V型;sp2;极性;
(3)序号“8”单质的熔点最高,第三周期8种元素单质熔点最高的为原子晶体Si,
故答案为:Si;
(4)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高,
故答案为:SiC;SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高.
点评:本题考查物质结构与性质,涉及元素周期表、核外电子排布规律、杂化理论、分子结构与性质、晶体类型与性质等,难度中等,侧重考查学生对知识运用、分析解决问题能力.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是