题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( ) 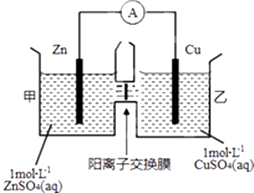
A.Zn电极上发生氧化反应
B.电子的流向为Zn→电流表→Cu
C.SO42﹣由乙池通过离子交换膜向甲池移动
D.电池工作一段时间后,乙池溶液的总质量明显增加
【答案】C
【解析】解:A.该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,故A正确; B.锌为负极,铜为正极,电子的流向为Zn→电流表→Cu,故B正确;
C.阳离子交换膜只允许阳离子和水分子通过,故SO42﹣不能由乙池通过离子交换膜向甲池移动,故C错误;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e﹣=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故D正确;
故选C.
由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,以此解答该题.

 阅读快车系列答案
阅读快车系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
请回答下列问题:
(1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1

(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______)
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- )
D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c( H+ )> c(OH-)