题目内容
【题目】下列叙述正确的是![]()
A.将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
【答案】C
【解析】
![]() 将稀氨水逐滴加入稀硫酸中,当溶液的
将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,则溶液中
时,则溶液中![]() ,根据电荷守恒
,根据电荷守恒![]() 可知:
可知:![]() ,即
,即![]() ,故A错误;
,故A错误;
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,设电离度分别为x、y,则
,设电离度分别为x、y,则![]() ;由于醋酸浓度越大,电离程度越小,即
;由于醋酸浓度越大,电离程度越小,即![]() ,则
,则![]() ,故B错误;
,故B错误;
C.醋酸为弱酸,![]() 的醋酸溶液醋酸的浓度大于
的醋酸溶液醋酸的浓度大于![]() ,而
,而![]() 的NaOH溶液中氢氧化钠的浓度为
的NaOH溶液中氢氧化钠的浓度为![]() ,两溶液混等体积合后醋酸过量,溶液显示酸性,则滴入石蕊溶液呈红色,故C正确;
,两溶液混等体积合后醋酸过量,溶液显示酸性,则滴入石蕊溶液呈红色,故C正确;
D.![]() 的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,氨水的电离平衡逆向移动,一水合氨浓度增大,溶液中氢氧根离子浓度减小,则溶液中
的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,氨水的电离平衡逆向移动,一水合氨浓度增大,溶液中氢氧根离子浓度减小,则溶液中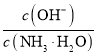 减小,故D错误;
减小,故D错误;
答案选C。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1