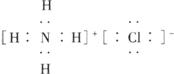��Ŀ����
�ƶ��⣺
��֪��A��BΪ�����ķǽ��������Ҿ�Ϊ���壻�ס���Ϊ�������ʣ�����I��Ũ��Һ�з����ۻ���C��H��J����Һ���ʼ��ԣ������ʼ��ת����ϵ����(����������δ��������δע����Ӧ����)��

(1)д����Ӧ�ڵĻ�ѧ����ʽΪ________��
(2)��Ӧ����ÿ����1 mol��G��ת�Ƶ��ӵ����ʵ���Ϊ________��
(3)��Ӧ�����ӷ���ʽ��________��
(4)ʵ�����б���I�ķ�����________��
������
|
����(1)4NH3��5O2 ����(2) ����(3)2Al��2H2O��2OH�� ����(4)��������ɫ�Լ�ƿ�У�����������(2��) |

��16�֣�������и��⣺
��K2Cr2O7����ɫ����Cr2(SO4)3����ɫ����K2SO4��H2SO4��C2H5OH��CH3COOH��H2O�ֱ�����ͬһ������ԭ��Ӧ�еķ�Ӧ���������÷�Ӧԭ���������ڼ��˾���Ƿ�ƺ���
����˾���ƺ������������������ʾ�� ɫ��
��д������ƽ�÷�Ӧ�Ļ�ѧ����ʽ�� ��
������ڷ�Ӧ������1mol�������ת�Ƶĵ�������Ϊ ��
���������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯����������Ӧ�����������ʣ���������β����Ⱦ��
��֪��N2(g)+ O2(g)="2NO(g) " ��H=+180. 5 kJ/mol [��Դ:ѧ*��*��]
5 kJ/mol [��Դ:ѧ*��*��]
2C(s)+ O2(g)="2CO(g) " ��H=��221.0 kJ/mol
C(s)+ O2(g)=CO2(g) ��H=��393.5 kJ/mol
��β��ת���ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g) ��H �� ��
��Ϊ�����β��ת���ķ�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩΪ ��
| A���Ӵ���ͬʱ�����¶� | B���Ӵ���ͬʱ����ѹǿ |
| C�������¶�ͬʱ����N2 | D�������¶�ͬʱ����ѹǿ |
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶϣ���(NH4)2CO3��Һ��pH 7���������������
����ͬ�¶��£������ʵ���Ũ�ȵ�������������Һ��pH�ɴ�С������˳��Ϊ
 ��������ţ�
��������ţ�a��NH4HCO3 b��NH4A c��(NH4)2CO3 d��NH4Cl
 4NO��6H2O(2��)
4NO��6H2O(2��) 2AlO
2AlO