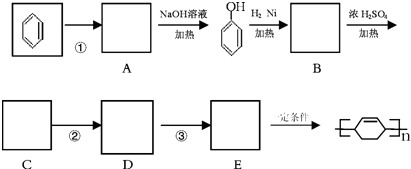
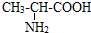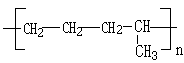题目内容
完成下列各题:
(1)K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车.
①若司机酒后开车,检测仪器内物质显示出
②写出并配平该反应的化学方程式:
③如果在反应中生成1mol氧化产物,转移的电子总数为
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=
②为了提高尾气转化的反应的速率和NO的转化率,采取的正确措施为
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
③该反应达到平衡时若增大压强,则混合气体的平均相对分子质量
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断:
①(NH4)2CO3溶液的pH
②相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
(1)K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车.
①若司机酒后开车,检测仪器内物质显示出
绿色
绿色
色.②写出并配平该反应的化学方程式:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
.③如果在反应中生成1mol氧化产物,转移的电子总数为
2.408×1024或4NA
2.408×1024或4NA
.(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=
-746.5kJ/mol
-746.5kJ/mol
.②为了提高尾气转化的反应的速率和NO的转化率,采取的正确措施为
B
B
.A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
③该反应达到平衡时若增大压强,则混合气体的平均相对分子质量
增大
增大
,若升高温度,则该反应的平衡常数减小
减小
(均填“增大”、“减小”或“不变”).(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断:
①(NH4)2CO3溶液的pH
>
>
7(填<、>、=).②相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为
c>a>b>d
c>a>b>d
.(填序号)a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
分析:(1)①根据题意知,乙醇是反应物,乙醇反应生成乙酸,碳元素失电子化合价升高,所以乙醇作还原剂;要使反应发生氧化还原反应,必须元素有化合价升高的和化合价降低的才可,乙醇作还原剂,必须有另一种物质得电子化合价降低,比较K2Cr2O7(橙色)、Cr2(SO4)3(绿色)中铬元素的化合价高低来判断氧化剂,根据生成物颜色判断检测仪器内物质颜色、
②根据反应物、生成物及得失电子数相等写出反应方程式.
③根据氧化产物和转移电子数之间的关系式计算.
(2)①根据已知方程推断所解方程,焓变相应变化.
②根据外界条件对化学反应速率和化学平衡的影响分析;
③根据外界条件对化学平衡的影响分析;
(3)①由题意知,HA的酸性比碳酸强,又知NH4A溶液为中性,判断(NH4)2CO3溶液的PH值大小.
②根据铵根离子和酸根离子的相对强弱来判断溶液的PH值大小顺序.
②根据反应物、生成物及得失电子数相等写出反应方程式.
③根据氧化产物和转移电子数之间的关系式计算.
(2)①根据已知方程推断所解方程,焓变相应变化.
②根据外界条件对化学反应速率和化学平衡的影响分析;
③根据外界条件对化学平衡的影响分析;
(3)①由题意知,HA的酸性比碳酸强,又知NH4A溶液为中性,判断(NH4)2CO3溶液的PH值大小.
②根据铵根离子和酸根离子的相对强弱来判断溶液的PH值大小顺序.
解答:解:(1)①根据题意知,乙醇是反应物,乙醇反应生成乙酸,碳元素失电子化合价升高,所以乙醇作还原剂;要使反应发生氧化还原反应,必须元素有化合价升高的和化合价降低的才可,乙醇作还原剂,必须有另一种物质得电子化合价降低,K2Cr2O7(橙色)中铬元素的化合价是+6价,Cr2(SO4)3(绿色)中化合价为+3价,所以K2Cr2O7(橙色)作氧化剂,还原产物是Cr2(SO4)3(绿色),显绿色.
故答案为:绿色.
②通过①知,K2Cr2O7、C2H5OH为反应物,Cr2(SO4)3、CH3COOH为生成物,根据元素守恒得,硫酸为反应物,硫酸钾、水为生成物,然后根据得失电子数相等配平,所以反应方程式为 2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.
故答案为:2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.
③由方程式知,氧化产物是乙酸,设转移电子x.
2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.转移电子
3mol 12 NA
1mol x
所以x=4 NA
故答案为:2.408×1024或4 NA.
(2)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/molⅠ
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/molⅡ
C(s)+O2(g)=CO2(g)△H=-393.5kJ/molⅢ
方程式Ⅲ×2-Ⅰ-Ⅱ得方程2NO(g)+2CO(g)=N2(g)+2CO2(g)
所以△H=(=-393.5kJ/mol )×2-(=+180.5kJ/mol )-(-221.0kJ/mol)=-746.5 kJ/mol
故答案为-746.5 kJ/mol.
②增大反应速率的方法有:增大压强、升高温度、加催化剂;该反应是气体体积减小的、放热的反应,为了提高一氧化氮的转化率.即使化学平衡向正反应方向移动,可采取、增大压强、降低温度、增大一氧化碳的浓度,要使反应条件同时符合两个条件,故选B.
③若增大压强,混合物体积减小,混合物的质量不变,所以平均相对分子质量增大;该反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,所以反应物浓度增大,生成物浓度减小,平衡常数减小.
故答案为:增大、减小.
(3)①HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性大于碳酸的酸性,NH4A溶液为中性,所以(NH4)2CO3溶液的
pH>7.
故答案为>.
②a.NH4HCO3 中碳酸氢根离子酸性大于碳酸根离子,HA的酸性大于碳酸的酸性,所以溶液呈碱性;
b.由题意知NH4A 呈中性;
c.(NH4)2CO3 呈碱性;
d.NH4Cl是强酸弱碱盐呈酸性.
所以PH值大小顺序为c>a>b>d.
故答案为:c>a>b>d
故答案为:绿色.
②通过①知,K2Cr2O7、C2H5OH为反应物,Cr2(SO4)3、CH3COOH为生成物,根据元素守恒得,硫酸为反应物,硫酸钾、水为生成物,然后根据得失电子数相等配平,所以反应方程式为 2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.
故答案为:2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.
③由方程式知,氧化产物是乙酸,设转移电子x.
2K2Cr2O7+3C2H5OH+8H2SO4=2 Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O.转移电子
3mol 12 NA
1mol x
所以x=4 NA
故答案为:2.408×1024或4 NA.
(2)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/molⅠ
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/molⅡ
C(s)+O2(g)=CO2(g)△H=-393.5kJ/molⅢ
方程式Ⅲ×2-Ⅰ-Ⅱ得方程2NO(g)+2CO(g)=N2(g)+2CO2(g)
所以△H=(=-393.5kJ/mol )×2-(=+180.5kJ/mol )-(-221.0kJ/mol)=-746.5 kJ/mol
故答案为-746.5 kJ/mol.
②增大反应速率的方法有:增大压强、升高温度、加催化剂;该反应是气体体积减小的、放热的反应,为了提高一氧化氮的转化率.即使化学平衡向正反应方向移动,可采取、增大压强、降低温度、增大一氧化碳的浓度,要使反应条件同时符合两个条件,故选B.
③若增大压强,混合物体积减小,混合物的质量不变,所以平均相对分子质量增大;该反应的正反应是放热反应,升高温度,平衡向逆反应方向移动,所以反应物浓度增大,生成物浓度减小,平衡常数减小.
故答案为:增大、减小.
(3)①HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性大于碳酸的酸性,NH4A溶液为中性,所以(NH4)2CO3溶液的
pH>7.
故答案为>.
②a.NH4HCO3 中碳酸氢根离子酸性大于碳酸根离子,HA的酸性大于碳酸的酸性,所以溶液呈碱性;
b.由题意知NH4A 呈中性;
c.(NH4)2CO3 呈碱性;
d.NH4Cl是强酸弱碱盐呈酸性.
所以PH值大小顺序为c>a>b>d.
故答案为:c>a>b>d
点评:本题考查了热化学方程式、化学平衡的影响因素等知识点,难度不大,注意热化学反应方程式相加减时,反应热相应的加减.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
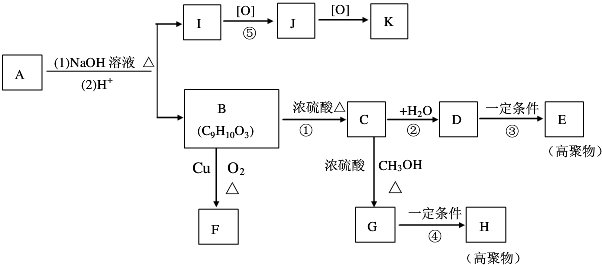
 完成下列各题.
完成下列各题.