题目内容
【题目】某学习小组为探究MnO2与FeCl3·6H2O的反应,设计了下列装置:
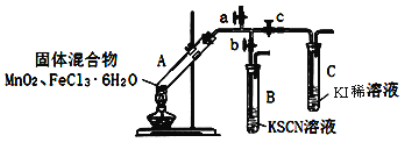
查阅文献有如下信息:①FeCl3 熔点282℃,沸点315℃, 2FeCl3 ![]() 2FeCl2+Cl2↑
2FeCl2+Cl2↑
②FeCl6·6H2O 熔点37℃,沸点285℃
实验过程记录:
操作步骤 | 现象 |
1.检查装置气密性,添加相应药品, 点燃酒精灯,开始给试管A加热 | |
2.打开a,关闭b、c, 用湿润的蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
3.打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
4.打开c,关闭a、b | C中溶液变棕黄色 |
5.停止加热 |
回答下列问题:
(1)A中的白雾是________________________。
(2)管壁内形成黄色液滴,可能的原因是______________________。
(3)B中溶液变红,请用离子方程式解释其原因_______________________。
(4)对C中溶液变黄色,小组展开进一步实验:
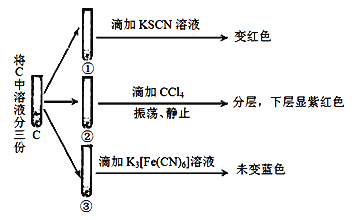
Ⅰ.C中变黄的原因是___________________________________________。
Ⅱ.C中发生反应的离子方程式是________________________________。
(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,写出A中生成该固体的化学方程式____________________________________。
(6)在A中MnO2发生的化学反应为__________________________________。
【答案】 盐酸水液滴 FeCl3·6H2O受热气化,在管壁遇冷所致 Fe3++3SCN-=Fe(SCN)3 Fe3+和I2共同导致 2I-+ Cl2=I2+2Cl- 2FeCl3·6H2O![]() Fe2O3+6HCl↑+9H2O↑ MnO2 +4HC1
Fe2O3+6HCl↑+9H2O↑ MnO2 +4HC1![]() Cl2↑ +MnCl2 +2H2O
Cl2↑ +MnCl2 +2H2O
【解析】(1)FeCl36H2O 受热失去结晶水FeCl36H2O![]() FeCl3+6H2O,同时水解FeCl3+3H2OFe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;(2)因为FeCl36H2O 的沸点282℃,所以加热会使FeCl36H2O气化,在管壁遇冷又转变成液体,所以试管及导管壁内附有黄色液滴;(3)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,所以B中溶液变红;(4)根据以上分析,C中变黄是Fe3+和I2的颜色,则证明有物质能够将I-氧化成I2,未检查到Fe2+,则证明铁离子不能氧化碘离子,二氧化锰与FeCl36H2O 反应生成的Cl2氧化的I-,C中发生反应的离子方程式是2I-+ Cl2=I2+2Cl-;(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,该物质是Fe2O3、反应方程式为:2FeCl3·6H2O
FeCl3+6H2O,同时水解FeCl3+3H2OFe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;(2)因为FeCl36H2O 的沸点282℃,所以加热会使FeCl36H2O气化,在管壁遇冷又转变成液体,所以试管及导管壁内附有黄色液滴;(3)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,所以B中溶液变红;(4)根据以上分析,C中变黄是Fe3+和I2的颜色,则证明有物质能够将I-氧化成I2,未检查到Fe2+,则证明铁离子不能氧化碘离子,二氧化锰与FeCl36H2O 反应生成的Cl2氧化的I-,C中发生反应的离子方程式是2I-+ Cl2=I2+2Cl-;(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,该物质是Fe2O3、反应方程式为:2FeCl3·6H2O![]() Fe2O3+6HCl↑+9H2O↑;(6)二氧化锰在加热条件下能把浓盐酸氧化为氯气,方程式为 MnO2 +4HC1
Fe2O3+6HCl↑+9H2O↑;(6)二氧化锰在加热条件下能把浓盐酸氧化为氯气,方程式为 MnO2 +4HC1![]() Cl2↑ +MnCl2 +2H2O。
Cl2↑ +MnCl2 +2H2O。