题目内容
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )
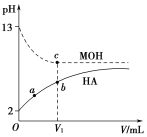
A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
【答案】C
【解析】
本题考查强弱电解质的稀释问题。解答时根据图像的pH知HA为弱酸,MOH为强碱;又知道稀释时促进弱电解质电离,其电离度也增大。无论强碱还是弱酸无限稀释其c(H+)近似相等的; MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-)。
A.若HA为强酸,则0.1 mol·L-1的该溶液pH=1,而图中其pH=2, HA为弱酸,故A项错误;B.对于HA溶液,在滴加蒸馏水前,溶液pH=2,即溶液中c(H+)=0.01 mol·L-1,故其电离度为10%,溶液越稀,促进电离,其电离度增大,故a点HA的电离度大于10%,故B项错误;酸碱溶液无限稀释时,溶液中的c(H+)≈c(OH-)≈1×10-7mol·L-1,故C项正确;D.由图像知MOH为强碱,完全电离,而HA为弱酸,部分电离,浓度均为0.1 mol·L-1的HA酸溶液和MOH碱溶液稀释相同倍数时,c(M+)>c(A-),故D项错误。

【题目】常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号 | 加入的酸 | 加入酸的浓度/(mol/L) | 混合后溶液的pH |
① | HA | 0.10 | 8.7 |
② | HB | 0.12 | 2 |
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L