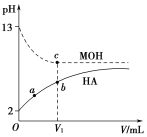
题目内容
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
【答案】D
【解析】
试题分析:硫化钠是强碱弱酸盐,硫离子水解导致该溶液呈碱性,要使![]() 减小,可以采用增大硫离子浓度或减小钠离子浓度来实现,据此分析解答.
减小,可以采用增大硫离子浓度或减小钠离子浓度来实现,据此分析解答.
解:①硫离子水解呈碱性,加适量盐酸,促进水解,导致硫离子浓度降低,![]() 增大,故错误;
增大,故错误;
②加适量NaOH(s),钠离子浓度增大且抑制硫离子水解,且钠离子增大程度远远大于抑制硫离子水解程度,所以![]() 增大,故错误;
增大,故错误;
③加适量KOH(s),钠离子浓度不变,但抑制硫离子水解,所以硫离子浓度增大,则![]() 减小,故正确;
减小,故正确;
④加适量KHS(s),钠离子浓度不变,硫氢根离子抑制硫离子水解,所以硫离子浓度增大,![]() 减小,故正确;
减小,故正确;
⑤加水,促进硫离子水解,钠离子物质的量不变、硫离子物质的量减小,所以![]() 增大,故错误;
增大,故错误;
⑥通H2S(g),硫离子和硫化氢反应生成硫氢根离子,所以硫离子浓度降低,![]() 增大,故错误;
增大,故错误;
⑦加热促进硫离子水解,硫离子浓度降低,所以![]() 增大,故错误;
增大,故错误;
故选D.

 53随堂测系列答案
53随堂测系列答案【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D