题目内容
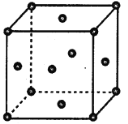
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
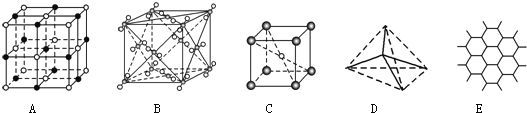
(1)代表金刚石的是________(填字母编号,下同),其中每个碳原子与______个碳原子最近且距离相等;金刚石属于________晶体。
(2)代表石墨的是_______,每个正六边形占有的碳原子数平均为_______个;
(3)代表NaCl的是_______,每个Na+周围与它最近且距离相等的Na+有_______个;
(4)代表CsCl的是_______,它属于_______晶体,每个Cs+与个_______Cl-紧邻;
(5)代表干冰的是_______,它属于_______晶体,每个CO2分子与_______个CO2分子紧邻;
(6)则上述五种物质熔点由高到低的排列顺序为______________(用字母编号回答)。
【答案】(1)D 4 原子
(2)E 2
(3)A 12
(4)C 离子 8
(5)B 分子 12
(6)石墨>金刚石>NaCl>CsCl>干冰
【解析】
试题分析:(1)金刚石是空间网状结构,每个碳原子连接4个碳原子,原子间以共价键相结合,属于原子晶体;
(2)石墨是平面层状结构,其晶体中碳原子呈平面正六边形排列,每个正六边形占有的碳原子数平均=1×![]() ×6=2;
×6=2;
(3)NaCl是离子晶体,其构成微粒是阴阳离子,NaCl晶胞是简单的立方单元,阴阳离子间通过离子键结合,氯离子和钠离子的配位数都是6,每个钠离子周围有6个氯离子,每个钠离子周围与它最接近且距离相等的钠离子数=3×8×![]() =12;
=12;
(4)CsCl是由阴阳离子构成的,属于离子晶体,氯离子和铯离子的配位数是8,故选C;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体;
(6)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比,金刚石是原子晶体、NaCl和CsCl是离子晶体、干冰是分子晶体、石墨是混合型晶体,根据配位数及晶胞结构知,A、B、C、D、E分别是NaCl、干冰、CsCl、金刚石、石墨,钠离子半径小于铯离子半径,石墨中C-C键长小于金刚石中C-C键长,所以这几种晶体熔点高低顺序是石墨>金刚石>NaCl>CsCl>干冰。

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
【题目】下列实验过程不能达到实验目的的是( )
实验目的 | 实验过程 | |
A | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
B | 配制100mL1.0mol/L CuSO4溶液 | 将25.0gCuSO4·5H2O配成100mL溶液 |
C | 验证X溶液中是否含有Fe2+ | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,观察溶液颜色变化 |
D | 除去固体KNO3中少量的NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤、洗涤、干燥 |
A.AB.BC.CD.D
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
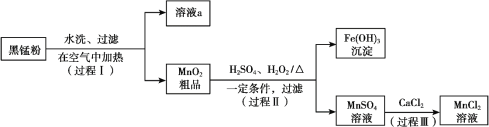
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
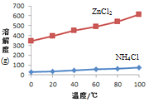
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。