题目内容
11.化学广泛应用于生产、生活,下列说法正确的是( )| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 往花生油中加入稀硫酸能发生皂化反应 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
分析 A.植物油由C、H、O三种元素组成;
B.葡萄糖含有醛基,能发生银镜反应;
C.油脂在碱性条件下水解叫皂化反应;
D.胆矾属于重金属盐,与蛋白质发生变性.
解答 解:A.汽油、柴油是碳氢化合物,植物油由C、H、O三种元素组成故不是碳氢化合物,故A错误;
B.葡萄糖含有醛基,能发生银镜反应,利用此性质可以制作镜子,故B正确;
C.油脂在碱性条件下水解叫皂化反应,可以制作肥皂,故C错误;
D.胆矾属于重金属盐,与蛋白质发生变性,不是盐析,故D错误.
故选B.
点评 本题主要考查有机物的性质,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
1.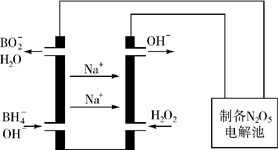 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
2.利用金属的活泼性不同,冶炼铝、铁、银分别应采用的方法是( )
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
19.下列说法不正确的是( )
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
6.在某一体积可变的恒温密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )


| A. | 0~t2时,v正始终大于v逆 | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ | |
| D. | t2时刻改变的条件可以是向密闭容器中加C |
3. 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )| A. | 脱硫反应△H<0 | |
| B. | 及时从体系中除去水,平衡常熟增大 | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | $\frac{n(N{H}_{3})}{n(S{O}_{2})}$:a<b<c |
20.下列分散系中,分散质粒子的直径大小在1~100nm之间的是( )
| A. | CuSO4溶液 | B. | Fe(OH)3胶体 | C. | 稀硫酸 | D. | 浑浊的石灰水 |