题目内容
【题目】某同学用如图所示的实验装置研究气体X的性质。气体X的主要成分是氯气,其中还含有水蒸气。请回答下列问题:
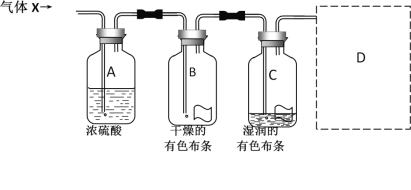
(1)该实验的主要目的是__________________________。
(2)与实验目的直接相关的实验现象是_________________________。
(3)图中所示的实验设计还存在不足。请根据相关物质的性质,在图中的D处画图补充有关实验装置和所用试剂。_______
【答案】探究干燥的氯气和湿润的氯气的漂白性(或探究C12能与水反应) B中干燥的有色布条不褪色,C中湿润的有色布条褪色 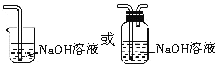
【解析】
根据实验装置,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收尾气中氯气,据此分析解答。
(1)本实验为对比实验,将氯气分别与干燥布条和湿润布条进行比较,干燥氯气不具有漂白性,有色布条不褪色,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,因此实验的目的是探究干燥的氯气和湿润的氯气的漂白性或探究C12能与水反应,故答案为:探究干燥的氯气和湿润的氯气的漂白性(或探究C12能与水反应);
(2)浓硫酸具有吸水性,常用作干燥剂,本试验中浓硫酸起到吸收气体X中的水的作用,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,B中干燥的布条不褪色,C中湿润的布条褪色,说明C12能与水反应或者湿润的氯气具有漂白性,故答案为:B中干燥的布条不褪色,C中湿润的布条褪色;
(3)氯气有毒,不能随意排放到空气中,应进行尾气处理,可用碱溶液来吸收,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,装置图为: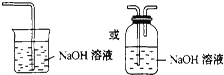 ,故答案为:
,故答案为:  。
。

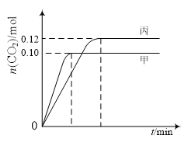
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。